第三节 红细胞的代谢
一、血红素的生物合成
成熟红细胞中,血红蛋白(hemoglolin,Hb)占红细胞内蛋白质总量的95%,它是血液运输O2的最重要物质,和CO2的送输亦有一定关系。血红蛋白是由4个亚基组成的四聚体,每一亚基由一分子珠蛋白(globin)与一分子血红素(heme)缔合而成。由于珠蛋白的生物合成与一般蛋白质相同,因此本节重点介绍血红素的生物合成。
血红素也是其它一些蛋白质,如肌红蛋白(myoglobin),过氧化氢酶(catalase),过氧化物酶(peroxidase)等的辅基。因而,一般细胞均可合成血红素,且合成通路相同。在人红细胞中,血红素的合成从早动红细胞开始,直到网织红细胞阶段仍可合成。而成熟红细胞不再有血红素的合成。
(一)血红素的合成通路(过程)
血红素合成的基本原料是甘氨酸、琥珀酰辅酶A及Fe++。合成的起始和终末过程均在线粒体,而中间阶段在胞液中进行。合成过程分为如下四个步骤:
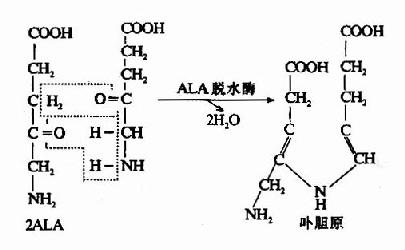
1.δ-氨基-γ-酮戊酸(δ-aminplevulinicacid,ALA)的生成:在线粒体中,首先由甘氨酸和琥珀酰辅酶A在ALA合成酶(ALa synthetase)的催化下缩合生成ALA。ALA合成酶由两个亚基组成,每个亚基分子量为60,000。其辅酶为磷酸吡哆醛。此酶为血红素合成的限速酶,受血红素的反馈抑制。

2.卟胆原的生成:线粒体生成的ALA进入胞液中,在ALA脱水酶(ALa dehydrase)的催化下,二分子ALA脱水缩合成一分子卟胆原(prophobilinogen,PBG)。ALA脱水酶由八个亚基组成,分子量为26万。为含巯基酶。
3.尿卟啉原和粪卟啉原的生成:在胞液中,四分子PBG脱氨缩合生成一分子尿卟啉原Ⅲ(uroporphyrinogen Ⅲ,UPG Ⅲ)。此反应过程需两种酶即尿卟啉原合酶(uroporphyrinogen synthetase)又称卟胆原脱氨酶(PBGdeaminase)和尿卟啉原Ⅲ同合酶(uroporphyrinogenⅢ cosynthase)。首先,PBG在尿卟啉原合酶作用下,脱氨缩合生成线状四吡咯。再由尿卟啉原Ⅲ同合酶催化,环化生成尿卟啉原Ⅲ。无尿卟啉原Ⅲ同合酶时,线状四吡咯可自然环化成尿卟啉原Ⅰ(UPG-Ⅰ),两种尿卟啉原的区别在于:UPGⅠ第7位结合的是乙酸基,第8位为丙酸基;而UPg Ⅲ则与之相反,第7位是丙酸基,第8位是乙酸基。正常情况下UPG-Ⅲ与UPG-Ⅰ为10000:1。
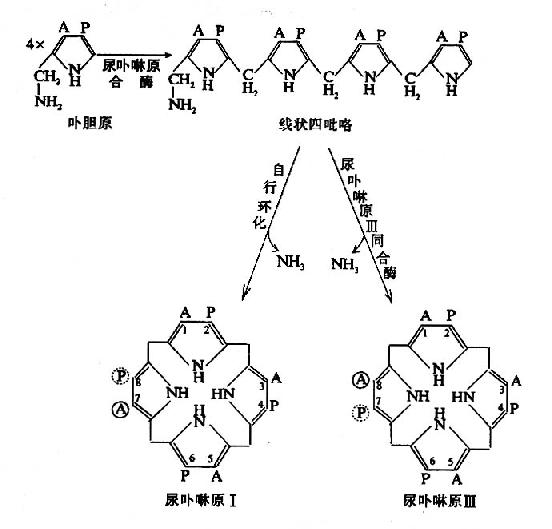
式中A代表乙酸基,P代表丙酸基
尿卟啉原Ⅲ进一步经尿卟啉原Ⅲ脱羧酶催化,使其四个乙酸基(A)脱羧变为甲基(M),从而生成粪卟啉原Ⅲ(coproporphyrinogen Ⅲ,CPG Ⅲ)。
4.血红素的生成:胞液中生成的粪卟啉原Ⅲ再进入线粒体中,在粪卟啉原氧化脱羧酶作用下,使2、4位的丙酸基(P)脱羧脱氢生成乙烯基(V),生成原卟啉原IX。再经原卟啉原IX氧化酶催化脱氢,使连接4个吡咯环的甲烯基氧化成甲炔基,生成原卟啉IX。最后在亚铁螯合酶(ferrochelatase)催化下和Fe2+结合生成血红素。(图10-18)。
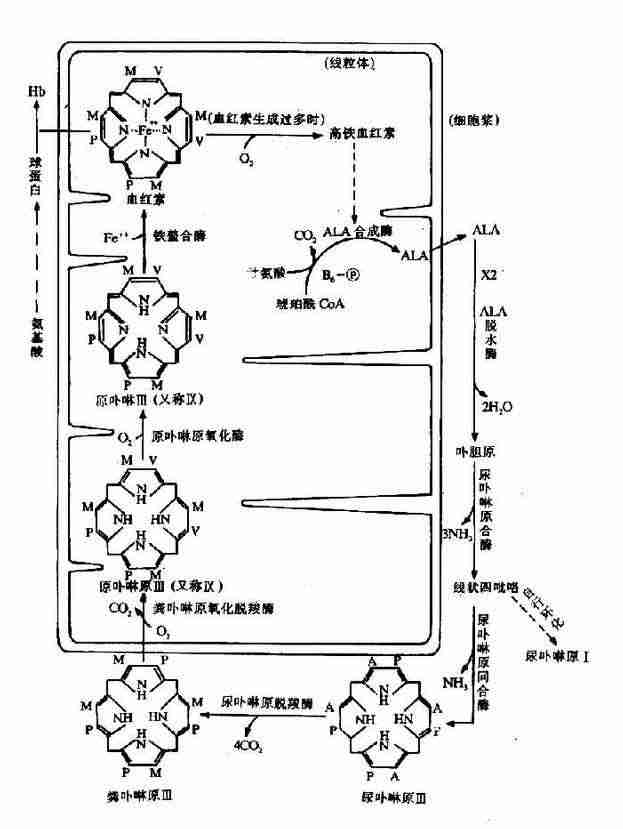
A.乙酸基 P.丙酸基 M.甲基 V.乙烯基
图10-18 血红素的生物合成及其调节
血红素生成后从线粒体转入胞液,与珠蛋白结合而成为血红蛋白。正常成人每天合成6克Hb,相当于合成210mg血红素。
(二)血红素合成的调节
血红素的合成受多种因素的调节,其中主要是调节ALA的生成。
1.ALA合成酶 血红素合成酶系中,ALA合成酶是限速酶,其量最少。血红素对此酶有反馈抑制作用。目前认为,血红素在体内可与阻遏蛋白结合,形成有活性的阻遏蛋白,从而抑制ALA合成酶的合成。此外,血红素还具有直接的负反馈调节ALA合成酶活性的作用。实验表明,血红素浓度为5×10-6M时便可抑制ALA合成酶的合成,浓度为10-5~10-4M时则可抑制酶的活性。正常情况下血红素生成后很快与珠蛋白结合,但当血红素合成过多时,则过多的血红素被氧化为高铁血红素(hematin),后者是ALA合成酶的强烈抑制剂,而且还能阻遏ALA合成酶的合成。
雄性激素——睾丸酮在肝脏5β-还原酶作用下可生成5β-氢睾丸酮,后者可诱导ALA合成酶的产生,从而促进血红素的生成。某些化合物也可诱导ALA合成酶,如巴比妥、灰黄霉素等药物,能诱导ALA合成酶的合成。
2.ALA脱水酶与亚铁螯合酶:ALA脱水酶和亚铁螯合酶对重金属敏感,如铅中毒可抑制这些酶而使血红素合成减少。
3.造血生长因子:目前已发现多种造血生长因子,如多系(multi)一集落刺激因子,中性粒细胞-巨噬细胞集落刺激因子(GM-CSF)、白细胞介素3(IL-3),及促红细胞生成素等。其中促红细胞生成素(erythropoiefin,EPO)在红细胞生长,分化中发挥关键作用。人EPO基因位于7号染色体长臂21区,由4个内含子和5个外显子组成。所编码的多肽由193个氨基酸残基组成。在分泌过程中经水解去除信号肽,成为166个氨基酸的成熟肽。分子量为18398。EPO为一种糖蛋白,由多肽和糖基两部分组成,总分子量为34000。糖基在Epo合成后分泌及生物活性方面均有重要作用。成人血清Epo主要由肾脏合成,胎儿和新生儿主要由肝脏合成。当循环血液中红细胞容积减低或机体缺氧时,肾分泌Epo增加。Epo可促进原始红细胞的增殖和分化、加速有核红细胞的成熟,并促进ALA合成酶生成,从而促进血红素的生成。
此外铁对血红素的合成有促进作用。而血红素又对珠蛋白的合成有促进作用。
血红素合成代谢异常而引起卟啉化合物或其前身体的堆积,称为卟啉症(porphyria)。先天性红细胞生成性卟啉症(congenitalerythropoietic porphyria)是由于先天性缺乏尿卟啉原Ⅲ同合酶,而使线状四吡咯向尿卟啉原Ⅲ的转变受阻,致使尿卟啉原Ⅰ生成增多。病人尿中有大量尿卟啉Ⅰ和粪卟啉Ⅰ出现。
二、成熟红细胞的代谢特点
成熟红细胞不仅无细胞核,而且也无线粒体、核蛋白体等细胞器,不能进行核酸和蛋白质的生物合成,也不能进行有氧氧化,不能利用脂肪酸。血糖是其唯一的能源。红细胞摄取葡萄糖属于易化扩散,不依赖胰岛素。成熟红细胞保留的代谢通路主要是葡萄糖的酵解和磷酸戊糖通路以及2.3一二磷酸甘油酸支路(2,3-biphosphoglycerate,2.3桞PG)。通过这些代谢提供能量和还原力(NADH,NADPH)以及一些重要的代谢物(2,3桞PG),对维持成熟红细胞在循环中约120的生命过程及正常生理功能均有重要作用。
(一)糖酵解
循环血液中的红细胞每天消耗约30g葡萄糖,其中90~95%经糖酵解被利用。一分子葡萄糖经酵解可产生2分子ATP。红细胞中生成的ATP主要用于维持红细胞膜上的离子泵(钠泵、钙泵),以保持红细胞的离子平衡;维持细胞膜可塑性;谷胱甘肽合成及核苷酸的补救合成等。缺乏ATP则红细胞膜内外离子平衡失调,红细胞内Na+进入多于K+排出、Ca++进入增多,红细胞因吸入过多水分而膨大成球状甚至破裂。同时由于ATP缺乏,可使红细胞膜可塑性下降,硬度增高,易被脾脏破坏,造成溶血。
红细胞无氧酵解中生成的NADH+H+是高铁血红蛋白还原酶的辅助因子,此酶催化高铁血红蛋白还原为有载氧功能的血红蛋白。
(二)2,3-二磷酸甘油酸(2,3-BPG)支路
在糖无氧酵解通路中,1,3-二磷酸甘油酸(1,3-BPG)有15~50%在二磷酸甘油酸变位酶催化下生成2,3-BPG,后者再经2,3-BPG磷酸酶催化生成3磷酸甘油酸。经此2,3-BPG的侧支循环称2,3-BPG支路(图10-19)。

图10-19 2,3-BPG支路
红细胞中2,3-BPG磷酸酶活性远低于BPG变位酶,使2,3-BPG的生成大于分解,因而红细胞中2,3-BPG的浓度处于有机磷酸酯的巅峰,较糖酵解其它中间产物的有机磷酸酯高出数+甚至数百倍(表10-4)。
表10-4 红细胞中各种糖酵解中间产物的浓度(微克分子/升红细胞)
| 糖酵解中间产物 | 动脉血 | 静脉血 |
| 6-磷酸葡萄糖 | 30.0 | 24.8 |
| 6-磷酸果糖 | 9.3 | 3.3 |
| 1,6二磷酸果糖 | 0.8 | 1.3 |
| 磷酸丙糖 | 4.5 | 5.0 |
| 3-磷酸甘油酸 | 19.2 | 16.5 |
| 2-磷酸甘油酸 | 5.0 | 1.9 |
| 磷酸烯醇式丙酮酸 | 10.8 | 6.6 |
| 丙酮酸 | 87.5 | 143.2 |
| 2,3-DPG | 3400 | 4940 |
2,3-BPG能特异地与去氧血红蛋白(deoxy Hb)结合,2,3-BPG进入血红蛋白α2β2四聚体中心空隙两个β亚基之间,借其分子中所带5个负电荷与两个β亚基的带正带氨基酸残基以盐键及氢键结合,使两个β亚基保持分开的状态,即促使血红蛋白由紧密态向松驰态转换,从而减低血红蛋白对氧的亲和力(图10-20)。
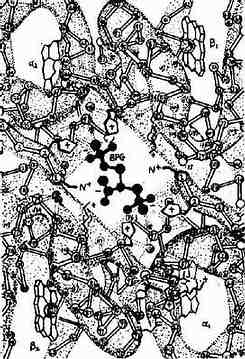
图10-20 BPG与Hb的作用示意图
当红细胞内2,3-BPG浓度升高时有利于HbO2放氧,而2,3-BPG浓度下降则有利于Hb与氧结合。BPG变位酶及2,3-BPG磷酸酶受pH值调节。在肺泡毛细血管血液pH高,BPG变位酶受抑制而2,3-BPG磷酸酶活性强。使红细胞内2,3-BPG的浓度降低,有利于Hb与O2结合。
反之,在外周组织毛细血管中,血液pH下降,2,3-BPG的浓度升高,则利于HbO2放氧,借此调节氧的运输和利用,具有重要生理意义。但2,3-BPG的生成是以减少一个ATP的生成为代价的。
(三)磷酸戊糖通路
红细胞内利用葡萄糖的5~10%通过磷酸戊糖通路代谢,为红细胞提供另一种还原力(NADPH),NADPH在红细胞氧化还原系统中发挥重要作用,具有保护膜蛋白、血红蛋白及酶蛋白的巯基不被氧化,还原高铁血红蛋白等多种功能。
1.GSH的主要生理功能是对抗氧化剂对巯基的氧化。细胞内可自发生成少量超氧阴离子(O-2),同时感染时的白细胞吞噬作用亦可产生O-2,可被超氧化物歧化酶(superoxidedismufase SOD),催化生成过氧化氢(H2O2)。

而GSH在谷胱甘肽过氧化酶作用下将H2O2还原为H2O,GSH自身被氧化为氧化型谷胱甘肽(GSSG)。后者在谷胱甘肽还原酶催化下,由NADPH+H+供氢重新还原为GSH。(图10-21)。
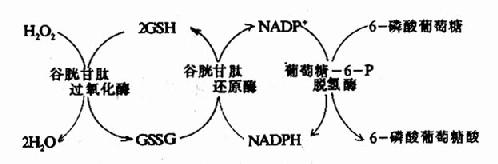
图10-21 谷胱甘肽的氧化与还原
催化NADPH生成的关键酶为葡萄糖-6-磷酸脱氢酶。此酶缺陷的病人一般情况下无症状,但有外界因素(如进食某种蚕豆)影响,即引起溶血。因吃蚕豆可诱导发病,故这种病又称蚕豆病。
2.高铁血红蛋白(methemoglobin MHb)的还原:由于各种氧化作用,红细胞内经常有少量MHb产生,而由于红细胞内有一系列酶促及非酶促的MHb还原系统(表10?),故正常红细胞中MHb只占1-2%。
表10-5 红细胞中MHb还原系统
| 还原系统 | 占总还原能力的百分比(%) |
| 酶促还原系统 | |
| NADH脱氢酶Ⅰ | 61 |
| NADH脱氢酶Ⅱ | 5 |
| NADH脱氢酶 | 6 |
| 非酶促还原系统 | |
| 抗坏血酸 | 16 |
| 谷胱甘肽 | 12 |
由表10-5可知,催化MHb还原的主要是NADH-脱氢酶,辅酶为NADH+H+。NADPH脱氢酶,(以NADPH+H+为辅酶)也参与MHb还作,但作用较小。除此之外,抗坏血酸和GSH可直接还原MHb,而氧化型抗坏血酸和GSSG的还原作用最终需NADPH+H+供氢。