第二节 血液凝固
血液的可凝固性质对机体有重要保护作用。当血管系统受伤时,必须迅速可靠地封闭起来,以尽可能减少出血。血小板变形(粘性变态)参于封闭作用,此种封闭作用要靠纤维蛋白凝结物的支持,而后者的形成是多种凝血因子相互作用,发生一系列酶促反应的结果。目前已发现的凝血因子有14种(表10-3)。
这些凝血因子除Ca2+外均为蛋白质,大多是由肝脏合成的血浆糖蛋白,它们大多属蛋白水解酶类。有7种为蛋白酶原,在凝血过程中被激活。无活性的凝血因子用罗马数码表示,其活性型以附加的下角码a字来表示。
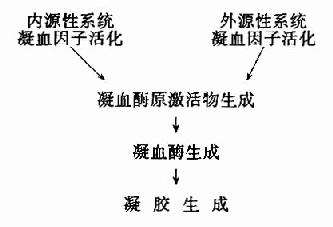
图10-1 血液凝固过程
一、血液凝固的机理
血液凝固的化学本质是溶胶状态的纤维蛋白原转变为凝胶状态的纤维蛋白,催化此反应的主 要是凝血酶。而正常血液中以无活性的凝血酶原形式存在,在一定条件下被激活而成为凝血酶。凝血酶原激活物是由活化的凝血固子与磷脂胶粒和钙形成的复合物。因此,凝血因子的活化是导致血液凝固的触发机制。据触发凝血过程的方式不同,又有内源性(intrinsic)与外源性(extrinsic)凝血之分。内源性凝血指因心血管内膜受损或血液抽出体外接触异物表面而触发的,仅有血管内凝血因子参与的凝血过程;而外源性凝血则指有受损组织释放的组织凝血活素所参与的凝血过程。血液凝固过程的梗概可图解如下:(图10-1)
二、凝血酶原激活物的生成
凝血酶原激活物由活化的凝血因子Xa、Va、Ca++及磷脂胶粒构成的复合体。因子X被激活为Xa是此过程的关键步骤。因子X的激活有两条途径:即内源性和外源性途径。
表10-3 凝血因于命名及其部分特性
| 凝血因子 | 同义名 | 合成场所 | 分子量 | 亚基数目 | 含糖量% | 血浆浓度mg% | 衍生物 | 功能 |
| Ⅰ | 纤维蛋白原(Fibrinogen) | 肝 | 340,000(人,牛) | 3×2 | 3-4 | 200-400 | 纤维蛋白 | 形成凝胶 |
| Ⅱ | 凝血酶原(Prothrombin) | 肝 | 68,700(人) 72,000(牛) | 1 | 8.2(人) 10-14(牛) | 10-15 | 凝血酶 | 蛋白酶 |
| Ⅲ | 组织凝血活素(Tissue Thromboplastin) | 各组织细胞 | 330,00 220,000(牛) | 辅因子 | ||||
| Ⅳ | 钙离子(Calcium Ion) | 辅因子 | ||||||
| Ⅴ | 前加速素(Proaccelerin) | 肝 | 290,000-400,000 | 多聚 | 11-18 | 5-10 | Ⅳ(Va) | 辅因子 |
| Ⅶ | 血清凝血活酶转变加速素(Convertin)又称SPCA) | 肝 | 63,000(人) | 1 | 9.1 | 0.4-0.7 | Ⅶa | 蛋白酶 |
| Ⅷ | 抗甲种箇以病球蛋白(Antihemotpilic Globulin简写AHG) | 肝为主 | 1,100,000(人,牛) | ? | 6(人) 9(牛) | 15-20 | Ⅷa | 辅因子 |
| Ⅸ | 血浆凝血活素成分(Plasma Thromboplastin简写PTC)又名抗乙种血友病因子 | 肝 | 55,400(人,牛) | 1 | 26 | 3-5 | Ⅸa | 蛋白酶 |
| Ⅹ | Stuart-Prower因子 | 肝 | 55,000(人,牛) | 1 | 10 | 5-10 | Ⅹa | 蛋白酶 |
| Ⅺ | 血浆凝血活素前质(Plasma Thro mboplastin Antecedent简写PTA)又名抗丙种血友病因子 | 肝?网状内皮系统? | 160,000(人,牛) | 2 | 12 | 0.5-0.9 | Ⅺa | 蛋白酶 |
| Ⅻ | 接因子(Hageman因子) | 网状内皮系统? | 90,00(牛) 82,000(人) | 3 | 15 | 0.1-0.5 | Ⅻa | 蛋白酶 |
| XⅢ | 纤维蛋白稳定因子(Fibrin Stabilizing Factor简写FSK) | 血水板?肝? | 320,000(血浆) 146,000-165,000 (血小板) | 5(血浆) | 1-2 | Ⅻa | 形成桥键 | |
| 前激肽释放酶(Prekallidrein) | 肝 | 80,000 | 1 | 10 | 1-2 | 激肽释放酶 | 蛋白酶 | |
| 高分子量激肽原(High Molecular Weight Kininogen HMWK) | 110,000-15,000 | 1 | ? | 7 | 缓激肽 | 辅因子 |
罗马数字后的a表示活化的意思(activated),因子Ⅵ实际上就是Ⅴa。
(一)内源性途径
内源性途径涉及多种凝血因子活化,可分为二步:
1.接触活化 是因子Ⅻ,也称Hagemann因子的激活作用。此蛋白质在接触到荷负电的表面,如玻璃或在体内接触到胶原蛋白时,发生构象改变,激活的因子Ⅻa为一蛋白酶,能将激肽释放酶原转变为激肽释放酶,又可活化因子Ⅻ,形成一个正反馈。同时因子Ⅻa还可激活下一个因子Ⅺ,将它转变为Ⅺa。此外,在Ⅻ因子活化中还有高分子量激肽原(high molecular weightkininogen,HMWK)的参与(图10-2)。
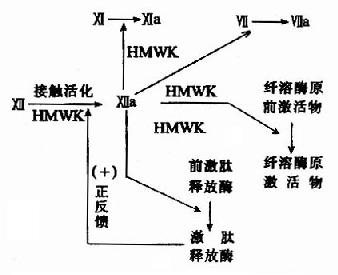
图10-2 内源性凝血的接触活化阶段
2.磷脂胶粒反应阶段:活化的Ⅻ即Ⅻa作用于因子Ⅺ,在Ca++的存在下水解因子Ⅺ产生Ⅺa,因子Ⅺa无酶活性,但可使因子X的活化反应速度提高1000倍。活化的因子X(即Xa)及凝血酶都有激活因子Ⅷ和Ⅴ的作用。活化的因子Xa、Va和Ca++结合在磷脂胶粒上形成凝血酶原激活物。磷脂胶粒是由血小板提供的富含丝氨酸磷脂的脂蛋白,对凝血因子和Ca++有较强的亲和力,从因子Ⅺ的活化到凝血酶原激活物的生成一系列反应均在磷胶胶粒上进行,故称磷脂胶粒反应阶段。(图10-3)
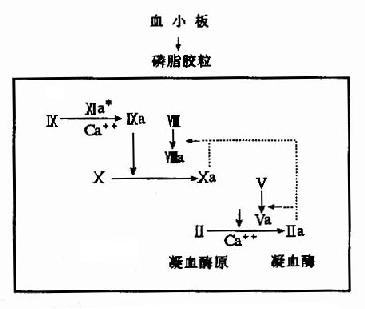
图10-3 内源性凝血的磷脂胶粒反应阶段
(*主要在外源性凝血中起作用因子Ⅶa亦可使因子活化·虚线……示正反馈回路)
(二)外源性途径
组织损伤后释放因子Ⅲ(组织凝血活素),它是一种脂蛋白,在脑、肺、胎盘等组织中含量最丰富,它的磷脂部分类似血小板所提供的磷脂胶粒,能把血浆中凝血因子Ⅶ和X通过Ca++桥而结合在其表面上。因子Ⅶ可由Ⅻa和凝血酶激活、亦可被Xa激活、Ⅶa可激活因子X产生Xa,而组织凝血活素的蛋白部分可使此反应加速16,000倍。未活化的因子Ⅶ也具有催化作用,但仅有Ⅶa的2%(图10-4)。
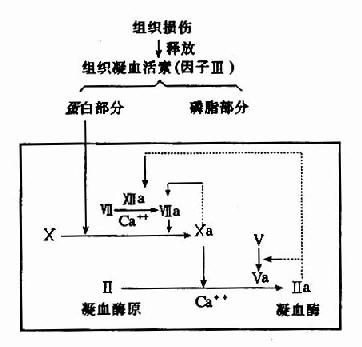
图10-4 外源性凝血中凝血酶原激活物的生成及凝血酶生成(虚线示正反馈回路)
三、凝血酶原的激活
凝血酶原(Ⅱ,prothrombin)是含582氨基酸残基的酶原,被因子Xa在Arg-Thr及Arg-Ile处切开,切除N端274个氨基酸残基,余下308个氨基酸残基分成A、B两条肽链,由一个二硫键相连,即为凝血酶(thrombin)。(图10-5)因子Va无酶活性,但可使Xa的活性增强350倍,加速凝血酶的生成。磷脂胶粒与酶(Xa)和底物(凝血酶原)之间借Ca++作为桥相连。因凝血酶原肽链的N未端含有10个γ羧基谷氨酸残基。相邻的羧基可与Ca++形成复合体。另一方面,Ca++又可与磷脂中磷酸基结合,这样使Xa和Va与凝血酶原接触在一起,于是Xa将凝血酶原水解为凝血酶(图10-6)。
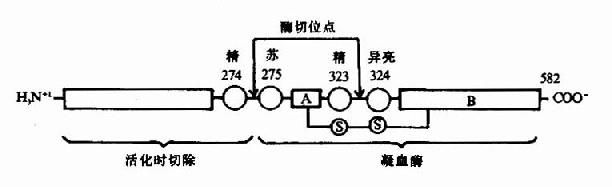
图10-5 因子Xa激活凝血酶原示意图
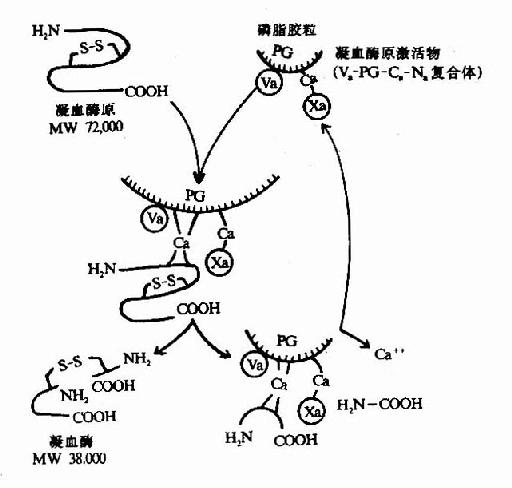
图10-6 凝血酶的生成
凝血酶原及因子Ⅶ、Ⅺ、Ⅹ均由肝合成,合成过程中需要维素K作为辅因子。缺乏Vitk则生成异常凝血酶原,只有正常活性的1?%。研究表明Vitk参与凝血酶原γ羧基谷氨酸的生成。Vitk参与羧基化的机理为:氢醌型Vitk在酶的催化下夺去γC上的一个质子,使γ-C呈阴离子,而和CO2结合。2,3环氧Vitk则在酶催化下被硫辛酸还原而重复利用,因而Vitk在此羧化反应中起辅酶的作用。(图10-7)
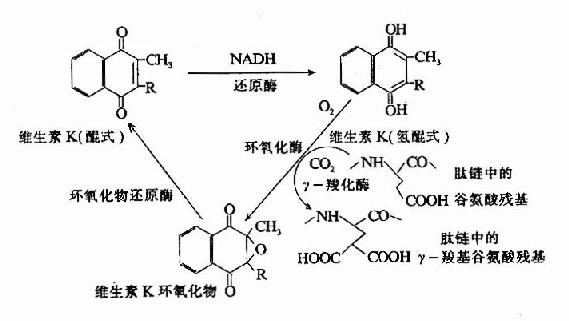
图10-7 维生素K在谷氨酸残基r-羧化反应中的作用(维生素K循环)
四、纤维蛋白原转变为纤维蛋白
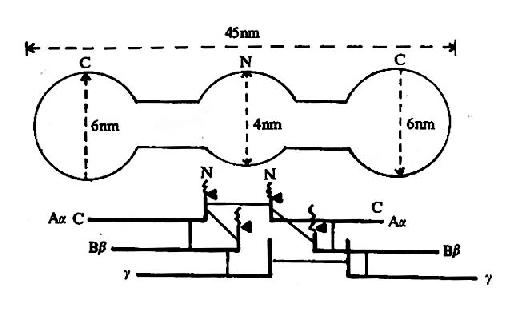
图10-8 纤维素蛋白原分子示意图
上半为电镜下的分子形状 下半示6条多肽链,
一为双硫键,▲为凝血酶作用点
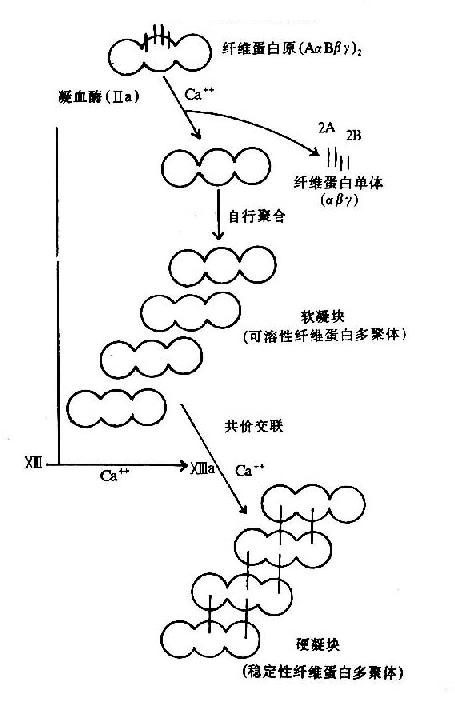
图10-9 纤维素蛋白凝胶的生成
血液凝固的实质是纤维蛋白凝胶的生成,它是血浆中纤维蛋白原(fibrinogen)在凝血酶作用下降解为纤维蛋白并聚合成不溶性的网状结构。
纤维蛋白原分子由两对α链、β-链及γ-链组成,每3条肽链(α、β、γ)绞合成索状,形成两条索状肽链,在N末端有二硫键使态个分子得到稳定。α及β肽链的N-端分别有一段16个及14个氨基酸的小肽,称为纤维肽A及B。因此,纤维蛋白原可写为(AαBβγ)2(图10-8)。
凝血酶的本质为一种蛋白水解酶,能特异性作用于Aα和Bβ链上的精-甘肽键。切除A、B纤维肽。因纤维肽A及B均为酸性肽,带较多负电荷。由于电荷排斥作用阻碍纤维蛋白原之间聚合。切除纤维肽A及B转变为纤维蛋白后负性减小,同时暴露了互补结合位点,有利于自动聚合,纤维蛋白单位通过边靠边、端靠端的聚合形成聚合链。此种多聚体不稳定,称为软凝块(soft clot)。它再通过因子XⅢa的作用结成牢固的网。因子XⅢa为转肽酶,能催化一个单体的谷氨酸残基的γ-羧基与另一单体的赖氨酸残基的氨基之间形成共价结合,其间释出NH3(图10-9,10)。因此,因子XⅢa称为纤维蛋白稳定因子(fibrin stabilizingfactor,FSF)。因子XⅢ存在于血小板及血浆中,经凝血酶切除部分肽段后被激活为XⅢa。
由此产生的稳定纤维蛋白网与软凝块不同,它们在5M的脲及1%氯乙酸溶液中不溶解。在血小板的血栓收缩蛋白作用下,此网状结构收缩,于是伤口边缘彼此靠近,易于伤口闭合。成纤维细胞的表面带有一种类似纤维蛋白的蛋白质,称粘连蛋白,它由Ⅻa催化与纤维蛋白结成网。并将纤维蛋白固定下来。所以,因子Ⅻa还直接参与伤口的愈合。
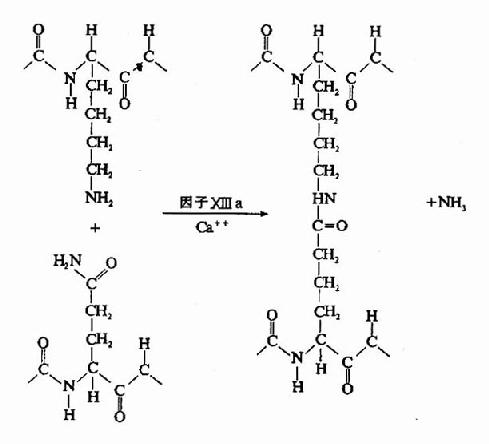
图10-10 因子XⅢa作用机理
总结上述凝血过程可归纳出以下特点:
1.凝血因子的活化本质上为蛋白质的有限水解,而许多凝血因了本身既是蛋白酶,又是酶作用的底物。这些本质为蛋白酶的凝血因子(Ⅱ、Ⅵ、Ⅺ、Ⅹ、Ⅻ)的氨基酸顺序很相似,与许多丝氨酸蛋白酶同源;活性中心的丝氨酸残基参与肽键的水解。C-端约250个氨基酸残基同源性很高,是具有催化活性的结构域。而N端的氨基酸序列变化较大,决定各凝血因子作用底物的专一性。它们催化的反应需Ca++和磷脂参加。
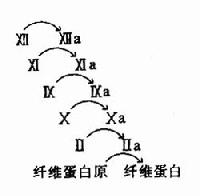
图10-11 血液凝固的瀑布效应
2.磷脂胶粒(内源性途径由血小板,外源性途径由组织凝血活素提供)使活化反应在胶粒表面进行,大大提高反应速度,而Ca++的作用在于促进酶和底物与磷脂表面的结合。
3.凝血因子活化呈瀑布效应(cascade)使血液凝固具有高效率和精密调控的特征。如图10-11所示。
4.维生素K在内、外源性凝血中均有重要作用。
5.凝血过程中的正反馈使反应不断加速,但终产物纤维蛋白有抗凝血作用。机体内凝血与抗凝血是密切联系的。
五、凝血作用的调节
由上所述,凝血过程是一个级联放大的瀑布效应,加之正反馈作用,可把最初生成的酶活性极大增强,把所有步骤加起来可增强106倍。如此高的激活速度会对机体构成危险,就是说,此过程一旦启动,整个血液就会凝固起来。此外,血凝可造成心肌梗死、脑血栓等严重疾病。因此,机体内的凝血作用必须保持适度。实事上,血浆及血管内皮等处存在着多种抗凝物质,凝血过程中生成的纤维蛋白(抗凝血酶Ⅰ)有强烈吸附凝血酶的作用。血浆中抗凝血蛋白(antithrombin抗凝血酶Ⅲ)是一种分子量约58,000的糖蛋白,能与具有蛋白酶作用的凝血因子(Ⅱa、IXa、Xa、Ⅺa、Ⅻa)以1:1分子比结合形成复合物,从而封闭酶的活性中心。肝素(heparin)能加速复合体的形成,使抗凝血酶的活性提高数百倍。肝素是由肥大细胞和嗜碱性粒细胞产生的高分子酸性粘多糖,是一种重要抗凝血物质、除上述作用外,尚具有抑制血小板的粘附、集聚,从而影响血小板磷脂的释放等作用。肝素作为抗凝剂已广泛应用于临床。
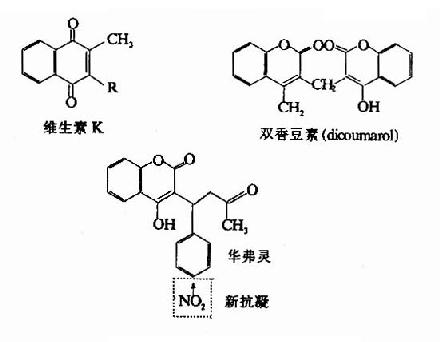
图10-12 几种抗凝物质结构
血浆中还存在另一种抗凝血的蛋白质桟蛋白。含Gla残基,是分子量约62,000的糖蛋白,以酶原形式存在,被凝血酶激活后能水解Ⅴa及Ⅶa,从而发挥抗凝血功能。先天性缺乏C蛋白者,往往在婴儿期即死于广泛的血栓。
除天然存在于血浆中的抗凝物质外,临床上常用一些人工抗凝剂如草酸盐和柠檬酸盐,它们的作用是通过螯合去除Ca。此外还有双香豆素类化合物能拮抗Vitk,而发挥抗凝血作用(图10-12)。
六、纤维蛋白溶解
血液凝固所产生的纤维蛋白可被血浆中纤维蛋白溶酶系统重新溶解,对于防止血栓形成和保持血流通畅具有重要意义。正常人的一些分泌液(如乳汁、唾液、泪液、子宫及阴道分泌物、精液等)中均含有纤维蛋白溶酶原(plasminogen)激活物,激活纤维蛋白溶解过程,随时清除分泌管道内的纤维蛋白,以保持分泌管道的通畅及月经血液的流动性。
(一)纤维蛋白溶解机理
纤维蛋白溶解(fibrinolysis)过程可分为二相,即纤维蛋白酶原激活和纤维蛋白溶解。
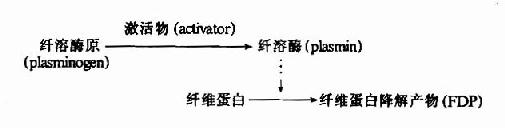
1.纤维蛋白酶原的激活
(1)纤维蛋白酶原激活物:
血液中纤维蛋白酶(plasmin,简称纤溶酶)以纤溶酶原形式存在,只有在纤溶激活物作用下转变为纤溶酶才具有活性。纤溶激活物可分为组织激活物和血液激活物两大类。
组织激活物主存在于组织细胞溶酶体中,以子宫、前列腺、甲状腺、肺、肾等含量较多。其中研究的最好的是肾中的尿激酶(urokinase),因其可少量出现在尿液中而得名。对肾小管血栓的溶解具有重要作用。
血液激活物主要来自静脉、微静脉的血管内皮细胞。在受到某些刺激(如剧烈运动、情绪紧张、创伤、休克等)时,可促使内皮细胞合成增多并释放入血。已知血小板释放5桯T对血管内皮细胞释放纤溶激活物具有重要意义。
此外,由溶血性链球菌提取的一种蛋白质称为链激酶(streptokinase),能与纤溶酶原形成复合物,后者具有纤溶激活物的性质。尿激酶和链激酶目前已广泛应用于临床溶栓治疗。
(2)纤溶酶原的激活
纤溶酶原为分子量86,000的蛋白。纤溶激活物均为蛋白水解酶,能水解纤溶酶原使之在肽链的ArgVal间切断而活化生成纤溶酶。纤溶酶本身亦可活化纤溶酶原,同时还可水解纤维蛋白原、因子Ⅴ、Ⅶ、IX和Ⅻ等,从而抑制凝血。
2.纤维蛋白的溶解
纤维蛋白的溶解过程是分步进行的,首先被纤溶酶水解释出A、B、C小分子多肽,留下X片段仍保留凝固特性。X片断进一步水解为片断D和Y,Y再水解为D和E片断。(图1013)最终分解产物为A、B、C、D、E五种片段。这些片断统称为纤维蛋白降解产物(fibrin degradationproduct,FDP)。FDP的生理作用是:片断X,Y可与纤维蛋白单体聚合,抑制多聚体的生成;片断D可直接抑制纤维蛋白单体的聚合;片断Y、E则可竞争抑制凝血酶。而且,大部分FDP可干扰血小板的粘附、聚集。可见FDP在抗凝中有重要作用。
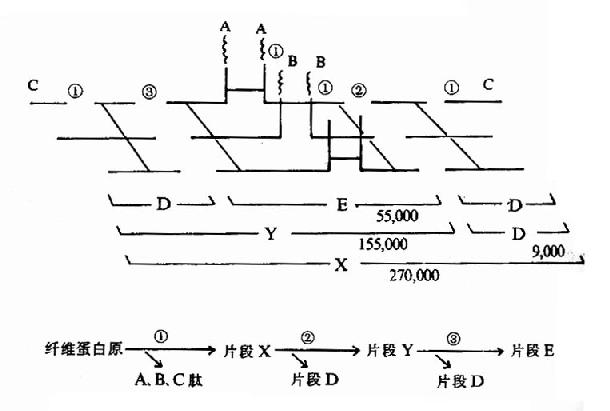
图10-13 纤溶酶对纤维蛋白(原)的降解(片段下的数字为分子量)
(二)纤溶抑制物
机体组织和体液广泛存在纤溶抑制物。按其作用可分为:纤溶酶原激活的抑制物;纤溶酶抑制物,又称抗纤溶酶(antiplasmin)。
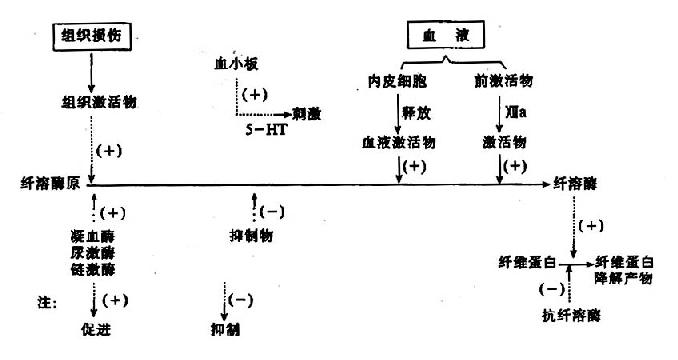
图10-14 纤维蛋白溶解过程
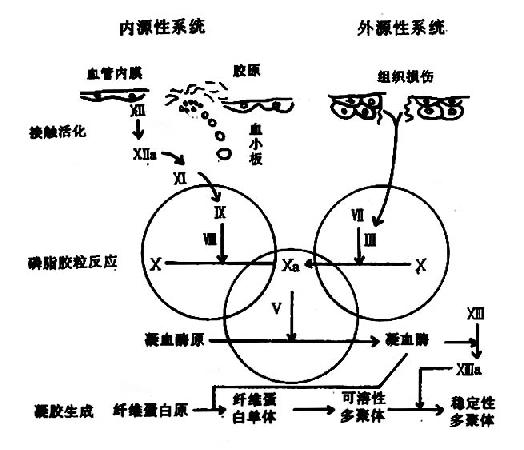
图10-15 凝血全过程示意图(→示转变或释放;→示催化作用;
除接触活化阶段外,均需Ca++参与,图中未显示)
正常血液中抗纤溶酶活性是纤溶酶活性的20?0倍。故在生理条件下,纤溶酶难以发挥作用。抗纤溶酶有两种:①慢作用的抗纤维酶,属α1抗胰蛋白酶,分子量为45,000,可与纤溶酶形成牢固的复合物。②快作用抗纤溶酶,属α2巨球蛋白,分子量80,000,是纤溶酶的竞争抑制剂。
血小板中纤溶抑制物是快速作用的抗纤溶酶。在血栓形成早期,血小板纤溶抑制作用大于纤溶激活作用;在血栓生成以后,随着血小板内5桯T的释放,则血管内皮释放血液激活物增多,又引起纤维蛋白溶解,防止血栓继续增长而阻塞血流循环。
因此可见机体内血液凝固、抗凝、纤溶与抗纤溶是相互抑制、相互协调、共同维护血液系统的正常生理功能,其相互关系可见图10-14~17。
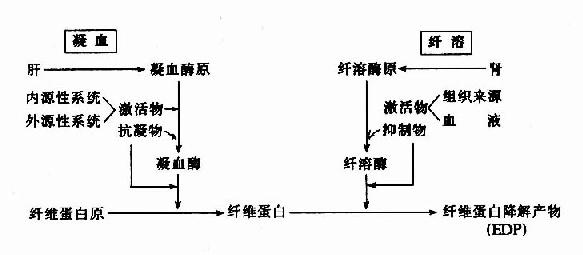
图10-16 凝血与纤溶的比较
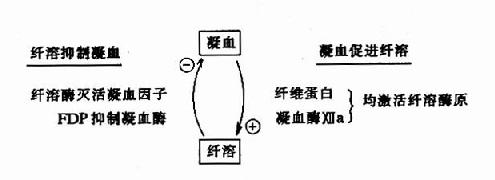
图10-17 凝血与纤溶的相互关系