三、子宫
子宫为肌性器官,腔窄壁厚,分底部、体部、颈部三部分。体部和底部的子宫壁由外向内分为外膜、肌层和内膜(又称粘膜)(图17-12)。
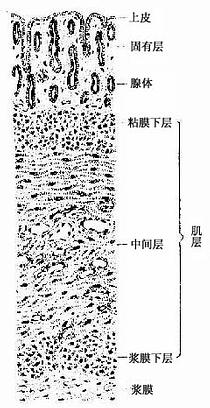
图17-12 子宫壁
(一)子宫壁的组织结构
1.外膜 子宫外膜(perimetrium)于底部和体部为浆膜,其余部分纤维膜。
2.肌层 子宫肌层(myometrium)甚厚,由成束或成片的平滑肌组成,肌束间以结缔组织分隔。肌层分层不明显,各层肌纤维互相交织,自内向外大致可分为粘膜下层、中间层和浆膜下层。粘膜下层和浆膜下层主要为纵行平滑肌束,中间层较厚,分内环行的外纵行肌,富含血管。成年妇女子宫平滑肌纤维长约50μm,妊娠时肌纤维显着增长,可长达500μm以上,肌纤维可分裂增殖,结缔组织中未分化的间充质细胞也可分化为肌纤维,使肌层增厚。分娩后,部分肌纤维恢复正常大小,部分肌纤维退化消失,增大的子宫恢复原状。子宫平滑肌的收缩受激素的调节,其收缩活动有助于精子向输卵管运送及经血排出和胎儿娩出。
3.内膜 子宫内膜(endometrium)由单层柱状上皮和固有层组成。内膜表面的上皮向固有层内深陷形成许多管状的子宫腺,其末端近肌层处常有分支。表面上皮与腺上皮结构相似,均由分泌细胞和少量纤毛细胞构成,但分布于子宫功能层的腺上皮细胞对卵巢激素反应敏感而有周期性变化,固有层较厚,血管较丰富,并有大量分化较低的梭形或星状细胞,称为基质细胞(stroma cell)。
子宫底部和体部的内膜可分为功能层(functional layer)和基底层(basal layer)两层。功能层位于浅部,较厚,自青春期起在卵巢激素的作用下发生周期性剥脱和出血。妊娠时,胚泡植入功能层并在其中生长发育。基底层较薄,位于内膜深部与肌层相邻,此层无周期性脱落变化,有修复内膜的功能。
子宫动脉的分支经外膜穿入子宫肌层,在中间层内形成弓形动脉。从弓形动脉发出许多放射状分支,垂直穿入内膜,在内膜与肌层交界处,每条小动脉发出一小而直的分支称基底动脉,分布于内膜基底层,它不受性激素的影响。小动脉主干从内膜基底层一直延伸至功能层浅部,呈螺旋状走行,称螺旋动脉(图17-13)。螺旋动脉在内膜浅部形成毛细血管网,毛细血管汇入小静脉,穿越肌层,汇合成子宫静脉。螺旋动脉对卵巢激素的作用很敏感。
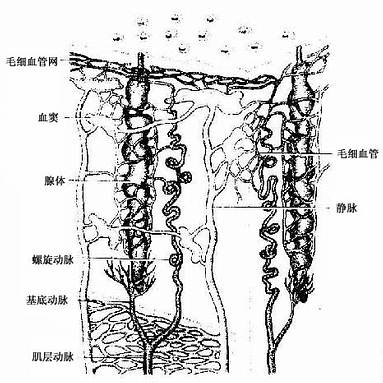
图17 -13 子宫内膜血管与腺模式图
(二)子宫内膜周期性变化
自青春期起,在卵巢分泌的雌激素和孕激素的周期性作用下,子宫底部和体部的功能层内膜出现周期性变化,每28天左右发生一次内膜脱与出血及修复和增生,称为月经周期(menstrual cycle)。每个月经周期是从月经第1天起至下次月经来前一天止。内膜周期性变化一般分为三期,即月经期、增生期和分泌期(图17-14)。
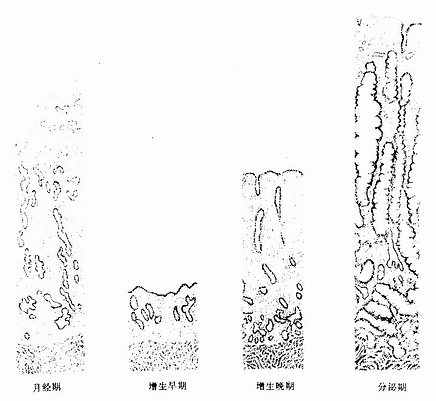
图17-14 子宫内膜周期性变化示意图
1.月经期月经期(menstrual phase)为周期第1~4天。由于卵巢内的黄体退化,雌激素和孕激素分泌量骤然下降,子宫内膜功能层的螺旋动脉发生持续性收缩,内膜缺血,组织坏死。螺旋动脉在收缩之后,又突然短暂地扩张,血液溢入结缔组织,最终突破退变坏死的内膜表层,流入子宫腔,从阴道排出,即为经血。退变及坏死的内膜呈小块状剥脱,直至功能层深部。月经期的持续时间一般为3~5天,因个体而差异并受环境变化的影响。在月经终止前,内膜基底层子宫腺残端的细胞迅速分裂增生,并铺展在脱落的内膜表面,内膜修复而进入增生期。
2.增生期 增生期(proliferation phase)又称卵泡期(follicular phase),为周期的第5~14天。此时期的卵巢内有若干卵泡生长,在卵泡分泌的雌激素作用下,子宫内膜发生增生性变化。在月经终止前,子宫内膜已修复,增生早期的子宫腺短直而细,数量较少。在整个增生期内的上皮细胞与基质细胞不断分裂增殖,子宫腺细胞对激素的反应也较强,雌激素使腺上皮逐渐生长与分化(图17-15)。至增生晚期(第11~14天),内膜增厚达1~3mm,子宫腺也增多,并不断增长和弯曲,上皮细胞分化成熟,胞质中糖原积聚,腺腔扩大。螺旋动脉也增长并弯曲。至增生期未,卵巢内的成熟卵泡排卵,子宫内膜由增生期转入分泌期。
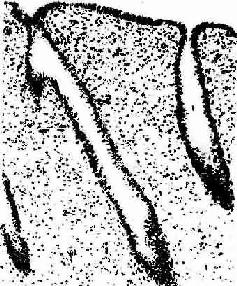
图17-15 人子宫内膜增生期
HE×320 ↓子宫腺
3.分泌期 分泌期(secretory phase)又称黄体期(luteal phase)。此时卵巢已排卵,黄体形成。子宫内膜在黄体分泌的雌激素和孕激素,尤其是孕激素的作用下继续增厚,于分泌早期(排卵后2天),子宫腺更弯曲,腔也变大,腺细胞核下区出现大量糖原聚积,细胞核则移至细胞顶部。在HE染色切片中,糖原被溶解,构成光镜下所见的核下空泡(图17-16)。随后,腺细胞核下区糖原渐转移至细胞顶部即核上区,并以顶浆分泌方式排入腺腔,腺腔内可见含糖原的嗜酸性分泌物(图17-17)。腺细胞分泌活动于周期第21天达高峰。腺细胞排泌后,细胞低矮,腺腔扩大呈锯齿状(图17-14)。此时期的固有层内组织液增多,内膜水肿,螺旋动脉增长并更弯曲,伸至内膜表层。于分泌晚期,基质细胞增生并分化形成两种细胞。一种为前蜕膜细胞(predecidual cell),细胞体积大而圆,胞质中含有糖原及脂滴;于妊娠期,前蜕膜细胞在妊娠黄体分泌的孕激素影响下,继续发育增大,成为蜕膜细胞。另一种细胞为内膜颗粒细胞,细胞体积较小,圆形,胞质内含有颗粒,细胞分泌松弛素。至分泌晚期,内膜可厚达5mm。卵若受精,内膜继续增厚;卵若未受精,卵巢内的月经黄体退变,孕激素和雌激素水平下降,内膜脱落又转入月经期。
绝经后,卵巢功能退化,激素分泌停止,子宫内膜萎缩变薄,仅残留稀少而细小的腺体。

图17-16 人子宫内膜分泌早期的子宫腺HE×400 ↑示腺细胞核下空泡
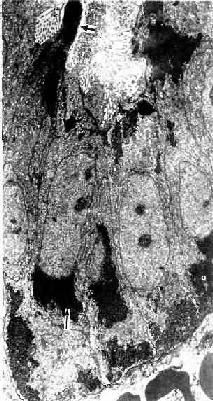
图17-17人子宫内膜分泌早期子宫腺电镜像 ×6000
↑腺细胞核下糖原斑,(
(三)子宫颈
子宫颈为子宫下端较窄的圆柱体,长约3cm,突入阴道的部分称为宫颈道部,在阴道穹窿以上的部分称阴道上部。子宫颈管腔细窄呈梭形,子宫颈壁由外向内分为外膜、肌层和粘膜。外膜是结缔组织构成的纤维膜,肌层由平滑肌及含有丰富弹性纤维的结缔组织组成,平滑肌数量从宫颈上端至下端逐渐减少。子宫颈粘膜由单层柱状上皮及固有层组成。子宫颈管前、后壁粘膜分别形成一条纵襞,从纵襞向外又伸出许多斜行皱臂,皱臂之间的裂隙形成腺样隐窝。粘膜上皮由分泌细胞、纤毛细胞及储备细胞(reserve cell)构成。宫颈粘膜无周期性脱落,但上皮细胞的活动受卵巢激素的调节。分泌细胞数量较多,胞质中充满粘原颗粒,雌激素促使细胞分泌增多,分泌物为稀薄粘液,有利于精子通过。孕激素使细胞分泌减少,分泌物粘稠呈凝胶状,形成阻止精子及微生物进入子宫的屏障。纤毛细胞数量较少,纤毛向阴道方向摆动,以助分泌物排出。储备细胞小,位于柱状细胞与基膜之间,散在分布,细胞分化较低,在上皮受损伤时有增殖修复功能。子宫颈慢性炎症时,储备细胞增殖化生为复层扁平上皮,在增生过程中也可发生癌变.在宫颈外口处,单层柱状上皮移行为复层扁平上皮,两种上皮分界清晰,交界处是宫颈癌好发部位.
子宫颈阴道部的复层扁平上皮与阴道上皮相似,细胞内含丰富的糖原。在性激素周期的影响下,上皮细胞的结构和功能可略有变化。
绝经后,宫颈变小,质硬,粘膜萎缩,腺样隐窝减少,分泌功能低下。
(四)卵巢和子宫内膜周期性变化的神经内分泌调节
女性生殖器官的周期性变化,主要在神经系统调控下受下丘脑、脑垂体和卵巢的激素的调节,称此为下丘脑-垂体-卵巢轴(图17-18).下丘脑弓状核等神经内分泌细胞分泌促性腺激素释放激素(G nRH),促使腺垂体分泌FSH和LH,LH的合成与释放受GnRH的严格控制,FSH的分泌还受其他因素的影响。FSH刺激卵泡的生长和成熟,并分泌雌激素(雌二醇),在FSH的协同作用下促成排卵及黄体形成。
月经来潮时,血液内的FSH开始略有升高;在卵泡发育早期,FSH维持较低水平,随着卵泡的生长,雌激素分泌量逐渐增高,子宫内膜呈增生期变化。约在排卵前2天,血液内雌激素含量达高峰,高水平的雌激素和GnRH的作用促使垂体分泌大量LH,出现排卵前LH释放高峰;与此同时血液内FSH也增高,但峰值比LH低。雌激素可增强促性腺激素细胞对GnRH的反应性,并促使其合成的激素大量释放,排卵常发生于LH高峰后24小时左右。排卵后,卵泡壁LH的作用下形成黄体,分泌大量孕激素(孕酮)和一些雌激素,子宫内膜在这两种激素作用下呈分泌期变化。血液内高水平的孕激素和雌激素还对下丘脑和垂体起负反馈作用,分别掏LH和FSH的分泌。当黄体缺乏LH的支持作用,即逐渐退化,孕激素和雌激素水平下降,子宫内膜遂发生退变和剥脱。
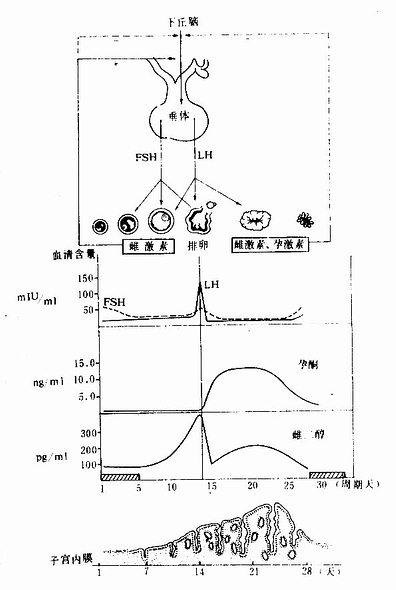
图17-18下丘脑、垂体、卵巢内分泌与子宫
内膜周期变化的关系