第二节 高血压
高血压(hypertension)为人类最常见的疾病之一,据流行病学调查,估计我国现有高血压患者约5000万人,每年新发病例约120万人。广义而言,体循环长期持续的不正常的血压升高称为高血压。
正常人的血压在不同的生理状况下有一定的波动幅度。收缩压和舒张压均随年龄的增长而升高,但是,舒张压升高不明显。因此,舒张压升高是判断高血压的重要依据。据世界卫生组织(WHO)建议,高血压的诊断标准如下:
1.正常成人血压 收缩压为18.6kPa(140mmHg)或以下,舒张压在12kPa(90mmHg)或以下。
2.成年人高血压 收缩压为21.3kPa(160mmHg)或以上和(或)舒张压在12.6kPa(95mmHg)或以上。
3.临界性高血压 收缩压高于18.6kPa而低于21.3kPa,舒张压高于12kPa而低于12.6kPa。
高血压可分为特发性高血压(essential hypertension)和继发性高血压(secondary hypertension)。前者又称原发性高血压(primary hypertension),后者又称为症状性高血压(symptomatic hypertension)。前者原因尚未完全明了,后者由某些疾病引起,如慢性肾小球肾炎、肾动脉狭窄、肾上腺和垂体的肿瘤等。本节仅叙述原发性高血压,继发性高血压将在以后各章节有关疾病中述及。
原发性高血压比较常见,多发生于中年(35~40岁)以后,男性与女性的患病率无明显差别。
一、病因和发病机制
原发性高血压的病因和发病机制尚未完全明了,近年来,随着生理学、遗传学、神经内分泌学及分子生物学的发展,以及自发性高血压大鼠模型的建立,许多研究已达到分子水平。目前,各种学说中以Page的镶嵌学说(mosaic theory)比较全面,认为高血压并非由单一因素引起,而是由彼此之间相互影响的多种因素造成。
1.遗传因素 约75%的原发性高血压患者具有遗传素质(genetic predisposition),同一家族中高血压患者常集中出现。据信原发性高血压是多基因遗传病。据报道,高血压患者及有高血压家族史而血压正常者有跨膜电解质转运紊乱,其血清中有一种激素样物质,可抑制Na+/K+-ATP酶活性,以致钠钾泵功能降低,导致细胞内Na+、Ca2+浓度增加,动脉壁SMC收缩加强,肾上腺素能受体(adrenergic receptor)密度增加,血管反应性加强。这些都有助于动脉血压升高。近来研究发现,血管紧张素(AGT)基因可能有15种缺陷,正常血压的人偶见缺陷,而高血压患者在AGT基因上的3个特定部位均有相同的变异。患高血压的兄弟或姐妹可获得父母的AGT基因的同一拷贝。有这种遗传缺隐的高血压患者,其血浆血管紧张素原水平高于对照组。
2.膳食电解质 一般而言,日均摄盐量高的人群,其血压升高百分率或平均血压高于摄盐量低者。WHO在预防高血压措施中建议每人每日摄盐量应控制在5g以下。一项由32个国家参加共53个中心关于电解质与血压关系的研究结果表明,中国人群尿钠平均值为206mmol/24h,比其它中心高43mmol/24h,尿钠/钾比达6.7,是其它中心的2倍多。尿钠最高的是天津(242mmol/24h)。这与中国膳食的高钠、低钾有关。钾能促进排钠,吃大量蔬菜可增加钾摄入量,有可能保护动脉不受钠的不良作用影响。钙可减轻钠的升压作用,我国膳食普遍低钙,可能加重钠/钾对血压的作用。增加膳食钙摄量的干预研究表明,钙的增加使有些患者血压降低。
3.社会心理应激 据调查表明,社会心理应激与高血压发病有密切关系。应激性生活事件包括:父母早亡、失恋、丧偶、家庭成员车祸死亡、病残、家庭破裂、经济政治冲击等。遭受生活事件刺激者高血压患病率比对照组高。据认为,社会心理应激可改变体内激素平衡,从而影响所有代谢过程。
4.肾因素 肾髓质间质细胞分泌抗高血压脂质如前列腺素、抗高血压中性肾髓质脂等分泌失调,排钠功能障碍均可能与高血压发病有关。
5.神经内分泌因素 一般认为,细动脉的交感神经纤维兴奋性增强是本病发病的重要神经因素。但是,交感神经节后纤维有两类:①缩血管纤维,递质为神经肽Y(neuropeptide Y,NPY)及去甲肾上腺素;②扩血管纤维,递质为降钙素基因相关肽(calcitonin gene related peptide,CGRP)及P物质。这两种纤维功能失衡,即前者功能强于后者时,才引起血压升高。近年来,中枢神经递质和神经肽,以及各种调节肽与高血压的关系已成为十分活跃的研究领域。据报道,CGRP可能抑制大鼠下丘脑去甲肾上腺素的释放,在外周它可能抑制肾上腺神经受刺激时去甲肾上腺素的释放。有报道,从哺乳动物心脏和脑中分离出利钠肽(A、B及C型),启示了人体内有一个利钠肽家族。近来在局部肾素-血管紧张素系统(RAS)的研究取得了新进展。将小鼠肾素基因(Ren-2基因)经微注射装置注入大鼠卵细胞,形成了转基因大鼠种系TGR(mREN2)27,这种动物血压极高。用Northern印迹杂交法证明,Ren-2转基因表达在肾上腺、血管、胃肠及脑,并可表达于胸腺、生殖系统和肾。由于其表达于血管壁,可能使血管的血管紧张素形成增加,从而发生高血压和血管SMC肥大。
二、类型和病理变化
(一)良性高血压
良必高血压(benign hypertension)又称缓进型高血压。早期多无症状,往往是偶然发现。开始表现为全身细动脉和小动脉痉挛,呈间断性,血压亦处于波动状态,其后血压呈持续性升高。出现心血管并发症者,如冠状动脉粥样硬化,促进疾病的进展。晚期可因心力衰竭、心肌梗死或脑出血致死。因肾功能衰竭致死者少见。
1.动脉系统病变
(1)细动脉:是指中膜仅有1~2层SMC的细动脉(arteriole)及直径约1mm 及以下的最小动脉。常累及腹腔器官、视网膜及肾上腺包膜的细动脉,最严重的是肾脏入球动脉。由于细动脉反复痉挛,血管内压持续升高,内皮细胞虽可通过其细胞骨架的适应性来加强适应,但仍不能承受血管内压力升高的作用而被分开,内皮细胞间间隙扩大,血浆蛋白(含免疫球蛋白及纤维蛋白原)渗入内皮下间隙。局部区域中膜SMC可发生坏死,溶酶体酶释出,并可引起局部性蛋白溶解,以致该处管壁通透性升高。血浆蛋白的渗入连同由未坏死SMC产生的修复性胶原纤维及蛋白多糖使细动脉壁细胞愈来愈减少而陷于玻璃样变,形成细动脉硬化(arteriolosclerosis)。镜检下,细动脉内皮与中膜SMC之间有玻璃样物质沉积,其内的胶原纤维亦陷于均质化。随着疾病的发展,细动脉管壁愈来愈增厚、变硬,管腔狭窄,甚至可使管腔闭塞。
(2)肌型器官动脉:主要累及冠状动脉、脑动脉及肾动脉(弓形及小叶间动脉常被累及)。表现为中膜SMC肥大和增生,中膜内胶原、弹性纤维及蛋白多糖增加,使中膜增厚。内膜亦有血浆蛋白渗入,SMC增生,产生胶原和弹性纤维,内弹力膜分裂,管腔可有某种程度狭窄。
2.心脏的病变 主要为左心室肥大,这是对持续性血压升高,心肌工作负荷增加的一种适应性反应。在心脏处于代偿期时,肥大的心脏心腔不扩张,甚至略微缩小,称为向心性肥大(concentric hypertrophy)。心脏重量增加,一般达400g以上,甚至可增重1倍。肉眼观,左心室壁增厚,可达1.5~2cm;左心室乳头肌和肉柱明显增粗(图8-11)。镜检下,肥大的心肌细胞变粗,变长,并有较多分支。细胞核较长、较大(可形成多倍体)。由于不断增大的心肌细胞与毛细血管供养之间的不相适应,加上高血压性血管病,以及并发动脉粥样硬化所致的血供不足,便导致心肌收缩力降低,逐渐出现心腔扩张,称为离心性肥大(eccentric hypertrophy)。严重者可发生心力衰竭。
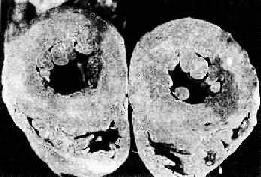
图8-11 高血压病时左心室向心性肥大(心脏横断面)
左心室壁增厚,乳头肌显著增粗
3.肾的病变 表现为原发性颗粒性固缩肾,为双侧对称性、弥漫性病变。
肉眼观,肾体积缩小,质地变硬,重量减轻,一侧肾重量一般小于100g(正常成年人一侧肾重约为150g)。表面布满无数均匀的红色细颗粒。切面,肾皮质变薄,一般在2mm左右(正常厚3~5mm)。髓质变化不明显,但肾盂和肾周围脂肪组织明显增生。
镜检下,肾细动脉硬化明显,小叶间动脉及弓形动脉内膜增厚。依病程而有多少不等的入球动脉及肾小球发生玻璃样变(图8-12)。附近的肾小管由于缺血而萎缩、消失,间质结缔组织增生及淋巴细胞浸润。该处由于肾实质萎缩和结缔组织收缩而形成凹陷的固缩病灶,周围健存的肾小球发生代偿性肥大,所属肾小管亦呈代偿性扩张,使局部肾组织向表面隆起,形成肉眼所见的无数红色细颗粒(由于该处血供良好而呈红色)。
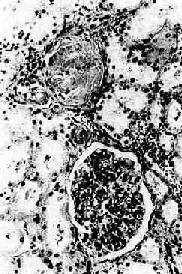
图8-12 高血压病之肾
肾小球入球小动脉管壁玻璃样变性,肾小球纤维化,玻璃样变
临床上,可多年不出现肾功能障碍。晚期由于病变的肾单位越来越多,肾血流量逐渐减少,肾小球滤过率逐渐降低。患者可发生水肿、出现蛋白尿及管型。严重者可出现尿毒症的临床表现。
4.脑的病变 高血压时,由于脑内细动脉的痉挛和病变,患者可出现不同程度的高血压脑病(hypertensive encephalopathy)症状,如头痛、头晕、眼花等,甚至出现高血压危象。患者有明显的中枢神经症状,如意识模糊、剧烈头痛、恶心、呕吐、视力障碍及癫痫发作等。
(1)脑动脉病变:严重的病例细动脉和小动脉管壁可发生纤维素样坏死,可并发血栓形成及微动脉瘤(microaneurysm)。后者好发于壳核、丘脑、脑桥、小脑和大脑,这些部位也是高血压性脑出血及脑梗死发生率最高之处。
(2)脑软化:由于细动脉、小动脉病变造成其所供养区域脑组织缺血的结果,脑组织内可出现多数小软化灶,即微梗死灶(microinfarct)。镜检下,梗死灶内脑组织坏死液化,形成染色较浅、质地疏松的筛网状病灶。灶内可见坏死的细胞碎屑,周围有胶质细胞增生及少量炎性细胞浸润。最后,坏死组织被吸收,由胶质瘢痕修复。由于软化灶较小,一般不引起严重后果。
(3)脑出血:是高血压最严重的且往往是致命性的并发症。多为大出血灶,常发生于基底节、内囊,其次为大脑白质、脑桥和小脑。出血区域的脑组织完全被破坏,形成囊腔状,其内充满坏死的脑组织和凝血块。有时出血范围甚大,可破入侧脑室(图8-13)。引起脑出血的原因一方面由于细、小动脉的病变,另一方面,脑出血多发生于基底节区域(尤以豆状核最多见),供养该区的豆纹动脉从大脑中动脉呈直角分出,直接受到大脑中动脉压力较高的血流冲击,易使已有病变的豆纹动脉破裂出血。此外,血压突然升高(如情绪激动时)亦易使病变的动脉破裂出血。临床上,患者常骤然发生昏迷、呼吸加深和脉搏加快。严重者可发生陈-施(Cheyne-Stokes)呼吸、瞳孔反射及角膜反射消失、肢体弛缓、肌腱反射消失、大小便失禁等症状。出血灶扩展至内囊时,引起对侧肢体偏瘫及感觉消失。出血灶破入侧脑室时,患者发生昏迷,常导致死亡。左侧脑出血常引起失语,脑桥出血可引起同侧面神经麻痹及对侧上下肢瘫痪。
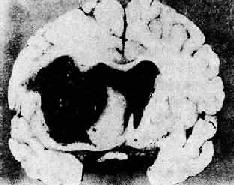
图8-13 高血压病之脑出血
大脑左侧内囊出血并破入侧脑室
5.视网膜的病变 视网膜中央动脉亦常发生硬化。眼底镜检查可见这些血管迂曲,颜色苍白,反光增强,呈银丝样改变。动、静脉交叉处静脉呈受压现象。严重者视乳头发生水肿,视网膜渗出和出血,患者视物模糊。
(二)恶性高血压
恶性高血压(malignant hypertension)又称为急进型高血压,可由良性高血压恶化而来,或起病即为急进性。病理变化主要见于肾和脑。
1.肾的变化 镜检下,可见细动脉坏死(arteriolonecrosis)(纤维素样坏死),坏死累及内膜和中膜,并有血浆成分内渗(insudation),使管壁极度增厚。HE染色切片上,受累血管壁呈嗜伊红性和折光性,免疫组织化学检查证明其中含有纤维蛋白、免疫球蛋白、补体。可见核碎片,但炎性细胞浸润极少见。有时可见到坏死性细动脉炎,在坏死的血管壁及周围有单核细胞及中性粒细胞浸润,但这种动脉炎不累及弓形动脉及叶间动脉。入球动脉坏死常波及肾小球,使肾小球毛细血管丛发生节段性坏死。细动脉坏死常并发血栓形成,可引起出血及微梗死。小动脉的变化颇具特征性,表现为增生性动脉内膜炎(proliferative endarteritis),内膜显著增厚,其内有多数SMC增生,并呈向心性排列,形成层状葱皮样病变。SMC产生大量胶原及蛋白多糖,管腔陷于高度狭窄。然而,这些变化并非恶性高血压所特有,类似的变化亦见于肾移植慢性排斥反应、进行性系统性硬化等。肉眼观,肾表面平滑,可见多数出血点,切面可见多数斑点状微梗死灶。
2.脑的变化 脑的细、小动脉亦可发生同样病变,常引起局部缺血、微梗死和脑出血。
临床上,有严重的高血压,血压值超过30.66/17.3kPa(230/130mmHg)。可发生高血压脑病。常有持续蛋白尿、血尿及管型尿。患者多于一年内因尿毒症、脑出血或心力衰竭致死。