第一节 动脉粥样硬化
动脉粥样硬化(atherosclerosis)是严重危害人类健康的常见病。近年来,本病的发病率在我国有明显增加的趋势。据尸检结果,在40~49岁的人群中,冠状动脉和主动脉粥样硬化病变的检出率分别为58.36%和88.31%,并随着年龄的增长而逐渐增加。
动脉硬化(arteriosclerosis)一般是指一组动脉的硬化性疾病,包括:动脉粥样硬化、Mönckeberg动脉中膜钙化和细动脉硬化。
一、动脉粥样硬化的危险因素
1.高脂血症 众所周知,高脂血症(hyperlipemia)是动脉粥样硬化的重要危险因素。高脂血症实际上也可认为是高脂蛋白血症,一般以成人空腹12~14小时血甘油三酯超过160mg/dl(1.81mmol/L),胆固醇超过260mg/dl(6.76mmol/L)为高脂血症。大量流行病学调查证明,血浆低密度脂蛋白(LDL)、极低密度脂蛋白(VLDL)水平持续升高与动脉粥样硬化的发病率呈正相关。越来越多的资料表明,LDL必须以某种方式修饰后(如氧化修饰)才致病。近年来,许多学者开始改用纯的脂蛋白颗粒进行研究,例如脂蛋白A(Lp(a))是一种混合颗粒,这种颗粒含有特别多的碳水化合物,它通过影响脂质代谢参与动脉粥样硬化的发生。目前我国人仍多以碳水化合物为主食,高碳水化合物膳食易发生高甘油三酯血症。已知高甘油三酯是本病的独立危险因素。相反,高密度脂蛋白(HDL)可通过胆固醇逆向转运机制清除动脉壁的胆固醇,将其转运至肝代谢并排出体外。此外,HDL有抗氧化作用,防止LDL氧化,并可通过竞争性抑制阻抑LDL与内皮细胞的受体结合而减少其摄取,因此,HDL有抗动脉粥样硬化作用。
2.高血压 据统计,高血压患者与同年龄组、同性别的人相比较,其动脉粥样硬化发病较早,病变较重。高血压时血流对血管壁的剪应力(shear stress,即血流冲击力)较高,同时,高血压可引起内皮损伤和(或)功能障碍,从而造成血管张力增高、脂蛋白渗入内膜、单核细胞粘附并迁入内膜、血小板粘附及中膜平滑肌细胞(SMC)迁入内膜等一系列变化,促进动脉粥样硬化发生。另方面,高血压时有脂质和胰岛素代谢异常。有报道认为,高血压患者脂质异常较血压正常者多见;高血压患者有高胰岛素血症及胰岛素抗性(患者对胰岛素不敏感,给予胰岛素患者的血糖降低不明显;给患者口服葡萄糖刺激后,胰岛素释放反应显著增高)。这些均可促进动脉粥样硬化发生。
3.吸烟 大量吸烟可使血液中LDL易于氧化,并导致血内一氧化碳浓度升高,从而造成血管内皮缺氧性损伤;烟内含有一种糖蛋白,可激活凝血因子Ⅻ及某种致突变物质,后者可引起血管壁SMC增生。吸烟可使血小板聚集功能增强及血液中儿茶酚胺浓度升高,但使不饱和脂肪酸及HDL水平降低。这些均有助于动脉粥样硬化的发生。
4.性别 女性的血浆HDL水平高于男性,而LDL水平却较男性为低。女性在绝经期前动脉粥样硬化的发病率低于同龄组男性,但在绝经期后这种性别差异即告消失,这是由于雌激素能影响脂类代谢,降低血浆胆固醇水平的缘故。
5.糖尿病及高胰岛素血症 糖尿病患者的血液HDL水平较低,而且由于高血糖可致LDL糖基化及高甘油三酯血症,后者可产生小而紧密的LDL颗粒,这种LDL较易氧化。这些修饰的LDL可促进血液单核细胞迁入内膜及转变为泡沫细胞。另外,大量调查资料证明,高胰岛素血症(hyperinsulinemia)与动脉粥样硬化的发生密切相关。胰岛素水平越高,冠状动脉心脏病(冠心病)的发病率及死亡率越高,反之,冠心病的发病率及死亡率较低。高胰岛素水平可促进动脉壁SMC增生,而且胰岛素水平与血HDL含量呈负相关。
6.贵传因素 冠心病的家族聚集现象提示贵传因素是本病的危险因素。家族性高胆固醇血症(familial hypercholesterolemia,FH)患者由于细胞的LDL受体基因突变以致其功能缺陷,导致血浆LDL水平极度升高。已知,至少有20种贵传性脂蛋白疾病,除FH外,如家族性高乳糜微粒血症(familial hyperchylomicronemia)(血浆乳糜微粒增高)、家族性脂蛋白脂酶缺乏(familial lipoprotein lipase deficiency)(血浆乳糜微粒增高)、家族性高甘油三酯血症(familial hypertriglyceridemia)(血浆VLDL、乳糜微粒增高、HDL降低)及家族性联合高脂血症等。
二、动脉粥样硬化发生机制学说
动脉粥样硬化的发病机制至今尚未完全明了,主要学说有:
1.脂源性学说 此说基于高脂血症与本病的因果关系。实险研究也证明,给动物喂饲富含胆固醇和脂肪的饮食可引起与人类动脉粥样硬化相似的血管病变。高脂血症可引起内皮细胞损伤和灶状脱落,导致血管壁通透性升高,血浆脂蛋白得以进入内膜,其后引起巨噬细胞的清除反应和血管壁SMC增生,并形成斑块。Anitschkow(1925)的浸润学说、Rössle(1943)的渗入学说,以及Doerr(1963)的灌注学说都是在这样的事实基础上建立的。
2.致突变学说 此学说为EP Benditt和JM Benditt(1973)所提出,认为动脉粥样硬化斑块内的平滑肌细胞为单克隆性,即由一个突变的SMC产生子代细胞,迁移入内膜,分裂增生而形成斑块,犹如平滑肌瘤一般。此起突变的原因可能是化学致突变物或病毒,其根据是,若女性的二倍体强胞核中X染色体的任一个基因是杂合子,机体将由两种不同等位基因型的细胞混合组成(镶嵌性)。目前以6-磷酸葡萄糖脱氢酶(G-6-PD)作为检测这两个等位基因的标记物。G-6-PD有两上异构体(A及B)。若增生病变来自镶嵌个体的单个细胞,则这种病变与正常组织含有两个表型相反,仅含有一个表型的G-6-PD。Benditt等在检查杂合子黑人妇女的正常主动脉及斑块中发现,斑块由产生一种表型的G-6-PD的SMC组成,而正常动脉壁则由两种表型的G-6-PD的SMC混合组成。因此认为这些病变是单克隆来源。
3.损伤应答学说 此说为Ross(1976)所提出,1986年又加以修改,认为动脉粥样硬化斑块形成至少有两个途径:①各种原因(机械性、LDL、高半胱氨酸、免疫性、毒素、病毒等)引起内皮损伤,使之分泌生长因子(growth factor,GF),并吸引单核细胞粘附于内皮。单核细胞迁移入内皮下间隙,摄取脂质,形成脂纹,并释放血小板源性生长因子(PDGF)样生长因子。脂纹可直接演变为纤维斑块,或由于内皮细胞脱落而引起血小板粘附。这样,血小板、巨噬细胞及内皮细胞均可产生生长因子,刺激中膜SMC增生。增生病灶内的SMC也可分泌PDGF样生长因子。②内皮细胞受损,但尚完整,内皮细胞更新增加,并产生生长因子,从而刺激中膜SMC迁移进入内膜,SMC及受损内皮细胞均可产生PDGF样生长因子,这种相互作用导致纤维斑块形成,并继续发展。
动脉粥样硬化的炎症学说:损伤应答学说实际上也是一种炎症观点。近年来,随着研究工作的不断深入,动脉粥样硬化发生的炎症学说又重新被强调。
4.受体缺失学说Brown和Goldstein(1973)首先发现人纤维母细胞有LDL受体。已知,该受体广泛分布于肝、动脉壁等全身各种组织细胞膜表面。血浆LDL与LDL受体结合后,聚集成簇,被内吞入细胞,并与溶酶体融合。在溶酶体酶的作用下,LDL中的apo B100被水解为氨基酸,胆固醇酯被水解为游离胆固醇及脂肪酸,前者通过以下途径调节细胞的胆固醇代谢:①抑制内质网的HMG CoA还原酶而抑制细胞本身胆固醇合成;②在转录水平上抑制细胞LDL受体蛋白质的合成;③激活内质网脂酰CoA胆固醇脂酰转移酶(ACAT)活性,使游离胆固醇酯化而储存于胞浆内。LDL被细胞摄取的量取决于细胞膜上受体的多少,若LDL受体数目过少,则导致细胞从循环中清除LDL减少,从而使血浆LDL升高。家族性高胆固醇血症是常染色体显性遗传病,患者由于细胞表面LDL受体功能缺陷而导致血浆LDL水平极度升高。患者多在早年发生冠心病而死亡。
三、病理变化
动脉壁的年龄变化:据国内研究,早在3个月胎龄时即见到主动脉内弹力膜分层,中膜浅层SMC空过弹力膜窗孔进入内膜,其后SMC增生,产生胶原、弹性纤维及蛋白多糖。内膜随着年龄增长而逐渐增厚。此外,在动脉杈或分支开口处常见小块白色增厚区,称为内膜垫(intimal cushion)。内膜垫由SMC、胶原纤维及蛋白多糖组成,可能是对血流剪应力的反应。据病理普查结果表明,动脉粥样硬化病变的发生与年龄的关系十分密切。动脉杈、分支开口及血管弯曲的凸面为病变的好发部位。
1.脂纹 脂纹(fatty streak)是动脉粥样硬化的早期病变。据尸检普查,9岁以下儿童的主动脉脂纹检出率为11.5%,10~19岁为48.96%。肉眼观,主动脉的脂纹常见于其后壁及分支开口处,为帽针头大小斑点及宽约1~2mm、长短不一的黄色条纹,不隆起或稍微隆起于内膜表面。
脂纹的形成多先有高脂血症,高脂血症或其它有害因子可造成内皮损伤,使其表面糖萼变薄,内皮细胞间间隙增宽。LDL与内皮细胞的高亲和性受体结合而被摄取,通过胞浆,进入内皮下间隙,并被内皮细胞及SMC释放的氧自由基氧化修饰,产生氧化LDL(OX-LDL)及氧化Lp(a)[OX-Lp(a)]。
在动脉分杈、分支开口处以及变曲动脉的凸面的血流剪应力减低,并可出现涡流,这使单核细胞易离开轴流与内皮接触。已知内皮细胞能分泌几种粘附分子,例如细胞间粘附分子(intercellular adhesion molecule-1,ICAM-1)及血管粘附分子(vascular adhesion molecule-1,VCAM-1)。ICAM-1可与白细胞表面的受体β2整合素(β2integrin,包括LFA-1及MAC-1)结合,VCAM-1可与白细胞的受体(VLA-4)结合,从而使单核细胞粘附于内皮表面。
单核细胞迁入内皮下间隙受多种因素影响。其中最重要的是SMC分泌的单核细胞趋化蛋白1(monocyte chemotactic protein 1,MCP-1),对单核细胞有很强的趋化活性。此外,动脉壁细胞产生的生长因子(如PDGF)及OX-LDL等对单核细胞亦有趋化活性。迁入内皮下间隙的单核细胞被激活并分化成巨噬细胞。
OX-LDL、OX-Lp(a)可与巨噬细胞表面的清道夫受体结合而被摄取。这些受体对胆固醇无下调作用,因而被巨噬细胞摄取的脂质愈来愈多,直至形成泡沫细胞(foam cell)(图8-1)。
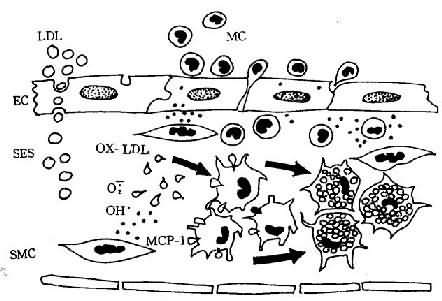
图8-1 单核细胞迁入内膜及泡沫细胞形成模式图
LDL渗入内皮下间隙(SES),被氧自由基氧化修饰;MCP-1释放,单核细胞(MC)迁入内膜,OX-LDL与巨噬细胞表面的清道夫受体结合而被摄取,泡沫细胞形成(EC:内皮细胞,SMC:平滑肌细胞)(仿Schwartz)
大量泡沫细胞聚集即形成脂纹,内皮隆起及变形。电镜下,巨噬细胞源性泡沫细胞表面富有突起,形成丝状伪足;胞浆内含有大量较小的脂质空泡和溶酶体,有时还见到胆固醇结晶;核卵圆或略呈肾形,异染色质常呈块状紧靠核膜,偶见1~2个核仁。内皮细胞、巨噬细胞及SMC均可分泌生长因子〔PDGF、纤维母细胞生长因子(FGF)、表皮生长因子(EGF)等〕,在其作用下,原已存在于内膜的SMC增生;中膜SMC发生表型转变(phenotypic modulation),即由收缩型(胞浆内含大量肌丝及致密体)转变为合成型(含大量粗面内质网、核蛋白体及线粒体);同时,SMC穿过内弹力板窗孔迁移入内皮下间隙并增生。SMC表面有LDL受体,可结合、摄取LDL及VLDL而成为泡沫细胞(肌源性泡沫细胞)。电镜下,肌源性泡沫细胞多呈长形,或有突起,多少保持SMC的特点,胞浆内可见肌丝和致密体,脂质空泡多少不定,一般稍大,有时能见到基底膜(图8-2)。
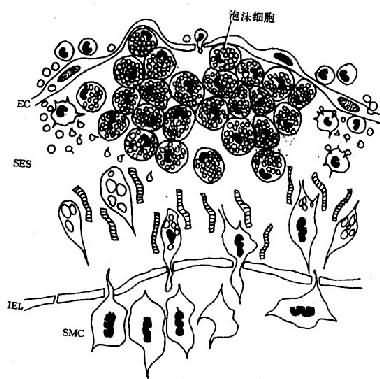
图8-2 脂纹组织结构模式图
内皮下间隙(SES)大量巨噬细胞源性泡沫细胞聚集,中膜SMC穿过内弹性膜(IEL)窗孔迁入内膜,增生并摄取脂质,内膜隆起及变形EC:内皮细胞病变的进展:已知OX-LDL具有细胞毒性,当大量OX-LDL被巨噬细胞摄取,超过了其清除能力时可引起泡沫细胞的坏死,导致细胞外脂质核心形成。加之,SMC大量增生,穿插于巨噬细胞源性泡沫细胞之间,产生胶原、弹性纤维及蛋白多糖,使病变演变为纤维斑块(图8-3)。
2.纤维斑块 肉眼观,纤维斑块(fibrous plaque)为隆起于内膜表面的灰黄色斑块。随着斑块表层的胶原纤维不断增加及玻璃样变,脂质被埋于深层,斑块乃逐渐变为瓷白色。镜检下,斑块表面为一层纤维帽,乃由多量SMC及大量细胞外基质(包括胶原、弹性纤维、蛋白聚糖及细胞外脂质)组成。纤维帽之下有不等量的增生的SMC、巨噬细胞及两种泡沫细胞,以及细胞外脂质及基质(图8-4,图8-5)。
由于OX-LDL的细胞毒性作用,以及很可能内皮细胞及SMC产生的氧自由基的作用,可引起斑块内细胞损伤及坏死。比较脆弱的巨噬细胞源性泡沫细胞坏死后,其胞浆内的脂质被释放出来,成为富含胆固醇酯的脂质池。泡沫细胞坏死崩解,释放出许多溶酶体酶,促进其它细胞坏死崩解。随着这些病理过程的发展,纤维斑块逐渐演变为粥样斑块。
3.粥样斑块 粥样斑块(atheromatous plaque)亦称粥瘤(atheroma)。肉眼观,为明显隆起于内膜表面的灰黄色斑块。切面,表层的纤维帽为瓷白色,深部为多量黄色粥糜样物质(由脂质和坏死崩解物质混合而成)(图8-6)。镜检下,纤维帽趋于老化,胶原纤维陷于玻璃样变,SMC被分散埋藏在细胞外基质之中。深部为大量无定形坏死物质,其内富含细胞外脂质,并见胆固醇结晶(石蜡切片上为针状空隙)、钙化等(图8-7)。底部和边缘可有肉芽组织增生,外周可见少许泡沫细胞和淋巴细胞浸润。病变严重者中膜SMC呈不同程度萎缩,中膜变薄。外膜可见新生毛细血管、不同程度的结缔组织增生及淋巴细胞、浆细胞浸润。一些学者认为,这种外膜炎症(慢性主动脉周围炎)可能是对粥瘤中的类蜡质(ceroid 一种含高度不饱和脂肪酸的黄色腊样物质)成分的一种自身免疫反应。
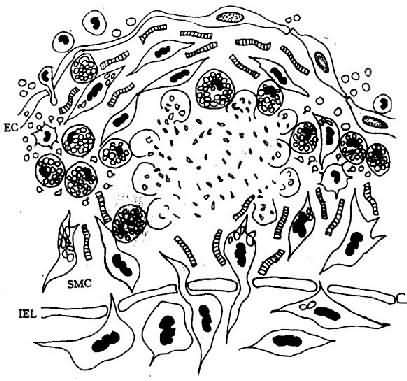
图8-3 脂纹的进展
泡沫细胞坏死及细胞外脂质核心形成,SMC继续增生,产生胶原、弹性纤维及蛋白多糖,使病变演变为纤维斑块

图8-4 发展中的纤维粥样斑块
斑块表层为脂纹,含有泡沫细胞和增生的平滑肌细胞;深层有大量胆固醇(针状结晶)析出和泡沫细胞散在。男性,25岁,主动脉。
(阜外医院病理科供图)
图8-5 发展中的纤维粥样斑块
图8-4的斑块深层。高倍镜下可见大量胆固醇结晶、泡沫细胞和增生的平滑肌细胞

图8-6 主动脉粥样硬化
主动脉内膜面见粥样斑块形成
4.复合病变
(1)斑块内出血:在粥样斑块的边缘常见到许多薄壁的新生血管。在血流剪应力作用下,这些薄壁血管常易破裂出血,可形成血肿,使斑块更加隆起,其后血肿被机化。
(2)斑块破裂:为最危险的并发症,斑块破裂常形成溃疡(粥瘤性溃疡)及并发血栓形成;坏死性粥样物质可排入血流而造成胆固醇栓塞。斑块破裂常见于腹主动脉下端、髂动脉和股动脉。富含软的细胞外脂质的斑块,特别是脂质池偏位时,容易破裂。斑块外周部分纤维帽最薄,含胶原、氨基葡聚糖及SMC较少,细胞外脂质较多,抗张强度较差,该处巨噬细胞源性泡沫细胞浸润也最多。因此,破裂往往发生在纤维帽的外周。
(3)血栓形成:表浅的或由于斑块破裂造成较深的内膜损伤,均可使胶原暴露,通过von Willebrand因子的介导,引起血小板的聚集而形成血栓,可引起器官动脉阻塞而导致梗死(如脑梗死、心肌梗死)。冠状动脉血栓的机化及再通可在一定程度上恢复该支动脉的血流,有助于保持梗死灶周围心肌的存活。
(4)钙化:多见于老年患者,钙盐可沉积于坏死灶及纤维帽内,动脉壁因而变硬、变脆。钙化灶可进而发生骨化。

图8-7 主动脉粥样硬化
内膜中形成粥瘤,其中为一些坏死物质及胆固醇结晶,表面内膜呈纤维性增厚
(5)动脉瘤形成:严重的粥样斑块底部的中膜SMC可发生不同程度的萎缩,以致逐渐不能承受血管内压力(张力)的作用而扩张,形成动脉瘤(aneurysm)。另外,血流可从粥瘤性溃疡处侵入主动脉中膜,或中膜内血管破裂出血,均可造成中膜撕裂,形成夹层动脉瘤(aneurysma dissecans)。
四、重要器官的动脉粥样硬化
(一)主动脉粥样硬化
病变多发生于主动脉后壁和其分支开口处。腹主动脉病变最严重,其次是降主动脉和主动脉弓,再次是升主动脉(图8-8)。病变严重者,斑块破裂,形成粥瘤性溃疡,其表面可有附壁血栓形成。有的病例因中膜SMC萎缩,弹力板断裂,局部管壁变薄弱,在血压的作用下管壁向外膨出而形成主动脉瘤。这种动脉瘤主要见于腹主动脉。偶见动脉瘤破裂,发生致命性大出血。有时可发生夹层动脉瘤。有的病例主动脉根部内膜病变严重,累及主动脉瓣,使瓣膜增厚、变硬,甚至钙化,形成主动脉瓣膜病。
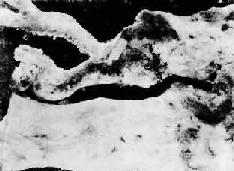
图8-8 主动脉粥样硬化
在主动脉内膜面上见隆起的粥样斑块并有溃疡形成
(二)冠状动脉粥样硬化
详见本章第十节。
(三)脑动脉粥样硬化
脑动脉粥样硬化发生较迟,一般在40岁以后才出现斑块。病变以Willis环和大脑中动脉最显著(图8-9)。据近年来报道,颈内动脉起始部及颅内部的粥样硬化病变相当常见,可有不同程度的管腔狭窄、斑块内出血、溃疡及附壁血栓形成。

图8-9 脑底动脉Willis环及其分支粥样硬化
本病时由于脑动脉管腔狭窄,脑组织因长期供血不足而发生萎缩。大脑皮质变薄,脑回变窄,脑沟变宽、加深,重量减轻。严重者常有智力减退,甚至痴呆。
严重的脑动脉粥样硬化使管腔高度狭窄,常继发血栓形成而导致管腔阻塞,脑组织缺血而发生梗死(脑软化)。脑软化多见于颞叶、内囊、尾状核、豆状核和丘脑等部位。镜检下,脑软化灶早期,组织变疏松,神经细胞变性、坏死,数量减少,周围有少量炎性细胞浸润。由小胶质细胞转变来的巨噬细胞摄取坏死组织崩解产生的脂质,使胞体增大,胞浆呈泡沫状。小软化灶可被吸收,由胶质细胞增生修复。较大的软化灶周围由增生的胶质纤维和胶原纤维围绕,坏死组织液化吸收形成囊腔。严重脑梗死可引起病人失语、偏瘫,甚至死亡。发生在延髓的软化灶可引起呼吸、循环中枢麻痹。脑动脉粥样硬化病变可形成小动脉瘤,当血压突然升高时可破裂出血。
(四)肾动脉粥样硬化
据统计,80%肾动脉粥样硬化性狭窄见于肾动脉开口处或主干近侧端,多为偏心的纤维斑块。严重者可导致肾动脉高度狭窄,甚或因并发血栓形成而完全阻塞。前者引起肾血管性高血压,后者引起受累动脉供血区域的梗死,梗死灶机化后形成较大块的凹陷瘢痕。多个瘢痕使肾缩小,称为动脉粥样硬化性固缩肾。
(五)四肢动脉粥样硬化
下肢动脉粥样硬化较上肢为常见,且较严重。股浅动脉在内收肌腱裂孔水平处最常发生阻塞,可能是由于动脉在该处易受大内收肌硬的腱弓反复机械作用所致。四肢动脉吻合支较丰富,较小的动脉管腔逐渐狭窄以至闭塞时,一般不发生严重后果。当较大动脉管腔明显狭窄时,可因肢体缺血在行走时出现跛行症状。当动脉管腔严重狭窄,继发血栓形成而侧支循环又不能代偿时,可发生供血局部的缺血性坏死(梗死),甚至发展为坏疽(图8-10)。
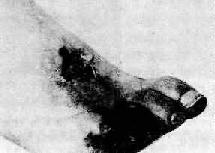
图8-10 右足趾坏疽