第二节 溶胶
溶胶的分散相粒子即胶体粒子,是由许多分子或原子聚集而成的,因此分散相与分散介质之间存在着相界面,形成多相体系,于是出现了大量界面现象。
一、界面现象
物体的表面是指它与空气或与本身的蒸气接触的面,而物体的表面与另一相接触的面则称为界面。凡是界面上发生的一切物理化学现象统称为界面现象。
(一)界面张力和界面能
由于物质分子与分子间存在相互吸引力的作用,位于表面层的分子和它的内部分子所处的情况是不同的。以液体为例来说明。图9-1中A为处于液体内部的分子,它从各方向所受到相邻分子的引力是均衡的,即作用于该分子上的吸引力的合力等于零。B处于液体表面层的分子,它所受到相邻分子吸引力的合力等于零,而且其合力是指向液体内部并与液面相垂直的。液体表面层的其它分子也都受到同样力的作用,其结果是这种合力企图把表面层的分子拉入液体内部,因面液体表面有自动缩小的倾向。如果想使表面增大,就必须使分子从液体内部反抗引力将其拉到表面,这一过程需要消耗一定量的功,这种功成为表面层分子多余的能量贮藏在表面上。这种液体表面层的分子比内部分子所多余的能量叫界面能(液体——空气),单位是J·m-2。
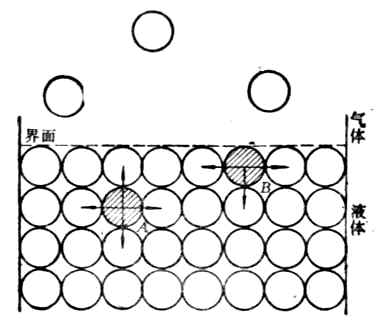

图9-1 表面张力来源 图9-2 表面张力的测量
在图9-2中,线圈A上面有一个无磨擦的滑动线B,将它们浸在(具有一定界面张力的)液体中,在线圈A和滑动线B围绕的平面上形成一层薄膜。因为液体表面有缩小的趋势,滑动线B将自动地向下移动。现在,我们从相反方向施以外拉力F以阻止其移动。这个力F将作用于薄膜的整个边缘l,力的大小随着长度l而改变。从实验中可以看到,作用于这个薄膜整个边缘的是每单位长度的力,这个力称界面张力,单位是N·m-1。也可用单位面积的能表示,称比表面能,单位是J·m-2。故界面张力又称比表面能。
(∵1J=1N·m ∴1J·m-2=1N·m·m-2=1N·m-1)
界面能等于界面张力(σ)与界面积(S)的乘积:
E=σ·S
物体的界面能有自动降低的趋势。界面能愈大,降低的趋势也愈大。液体界面能的减小可以通过一种自动过程来实现,即自动减小S或自动减小σ,或者S和σ两者同时减小。
恒温下,液体的σ是一个常数,因此界面能的减小只能通过减小S的办法进行。如水滴常呈球形——界面能最小。在溶液中界面积不变的情况下,界面能的减小只能用减小σ的办法进行,即液体界面从周围介质中自动吸引其它物质分子、原子或离子填入表面层来降低它的σ,即吸附作用。
(二)吸附
溶胶属多相分散系,分散相和分散介质之间有界面存在,对于一定体积的物质,分散粒子愈小,个数愈多,其总面积就愈大,比表面积(即单位体积物质的表面积)也就愈大。例如,当1cm3的物质分割到每边长10-5-10-7cm大小的立方体时,其比表面积达到60-600m2,因此大大改变了界面性质。
1.固体界面上的吸附
固体的表面不能自动缩小,它只能依赖于吸附其它物质以降低界面能。具有吸附作用的物质叫吸附剂,被吸附的物质叫吸附质。疏松多孔的固体,如活性炭、硅胶、活性氧化铝、铂黑等都是良好的吸附剂。1g良好活性炭的微孔界面积可达1000m2,常用于防毒面具中,也可用作蔗糖脱色。硅胶和活性氧化铝都可用作色层分析中的层析中的层析柱或薄层的吸附剂。铂黑用于氢电极以吸附氢。
2.固体-气体界面上的吸附
气体在固体界面上的吸附作用是可逆的。气体分子可被吸附到吸附剂的界面上,但由于分子的热运动,气体又可能挣脱界面进入气相,这种过程叫解吸。当吸附与解吸达到平衡时,单位质量吸附剂所能吸附气体的量叫做吸附量。吸附是放热过程,解吸是吸热过程。
当温度不变时,增加气体压力,吸附量增加。当气体的压力增加到一定程度时,吸附量达到一极限值,这时吸附剂界面的吸附已达到饱和,这种在给定温度下,以吸附量为纵坐标,以气体压力为横坐标作图所得的曲线,叫等温吸附线(图9-3)。
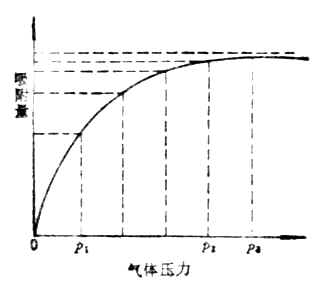

图9-3 吸附等温曲线 图9-4 柱层析法简单装置图
3.固体-液体界面上的吸附
固体-液体界面上的吸附,可能是溶质吸附,也可能是溶剂吸附,通常两者兼有只是程度不同。例如,活性炭从色素水溶液中吸附的色素就远比吸附的水多,因此可以用活性炭使溶液脱色。但是如果把活性炭放入色素的酒精溶液中,由于活性炭对酒精的吸附大于对色素的吸附,故不能用于在酒精溶液中对色素的脱色。
在固体-液体界面上的吸附中,吸附的溶质可以是电解质,也可以是非电解质。
分子吸附指吸附物质的整个分子被吸附在固-液界面上。被吸附物质是非电解质或弱电解质的分子型物质。利用各物质吸附能力的不同,选用适当的吸附剂,可将溶液中的各种溶质的混合物加以分离。利用各种溶质与吸附剂之间吸附能力的不同,使溶质得到分离的方法叫色谱法或层析法。如在一玻璃管(柱型)中,装入某种吸附剂(如氧化铝或硅胶)作为吸附柱。当把含各种溶质的溶液流经管中的吸附柱时,由于不同物质在吸附柱上的吸附能力不同,因而被吸附在柱的不同高度的位置上,最容易吸附的物质在柱的上部,其余依次向下。随后取出吸附柱,分层切开,再用溶剂分别提取,即被分离。或者用溶剂把被吸附物质由吸附柱上洗脱下来。在洗脱过程中,吸附力弱的先被洗出,吸附力强的后被洗出,将洗出液分段收集,同样达到分离的目的。。
例如,用石油醚提取绿叶中的成分:将石油醚加到绿叶中,使其作用后,把渣子滤去,将溶液倒入吸附柱,在柱上依次显出叶绿素、叶红素、胡萝卜素等色层(图9-4中的A,B,C)。然后分别提取即可得各种成分。
二、溶胶的性质
当光波投射到粒子上时,如果粒子大于波长,则光波以一定的角度从粒子表面反射出来。如果粒子远小于光波的波长,则光波绕过粒子前进不受阻碍。当粒子的大小和光波波长接近或稍小时,光波产生散射。溶胶粒子的大小在1-100nm之间,与普通光波波长接近,因此有一定强度的散射现象,称为丁铎尔(Tyndall)现象。即当一束强光投射到溶胶上,在暗室或黑暗背景下,从光束的垂直方向观察,可以清楚地观察到一条光带(图9-5),这是胶体溶液的特点。
溶胶中胶体粒子和溶液中溶质的粒子相似,也处于不停的运动状态,这种不停的无规则的运动称为布朗(Brown)运动(图9-6)。由此表现出与胶体粒子运动有关的性质,称为胶体的分子动力学性质,如扩散、渗透、沉降等。它们和胶体粒子的大小和形状有密切的关系。所以从分子动力学性质出发,可以研究胶体粒子的大小和形状。其次,溶胶由于分子动力学性质,可以保持胶体粒子不因重力作用而沉集在容器底部。这种保持分散相不从分散介质中分离出来的性质,称为动力学稳定性。

图9-6 丁铎尔现象

图9-6 布朗运动
(一)电泳
1.电泳
在一U形管中,加入棕色的氢氧化铁溶胶(图9-7左),然后插上电极并通直流电,阴极附近颜色逐渐变深,表示氢氧化铁胶体粒子向阴极移动(图9-7右)。如果在U形管中换上硫化砷溶胶并通电,胶体粒子向阳极移动。这种胶体粒子在电场作用下向阳极或阴极移动的现象叫电泳。
2.胶粒带电的原因
(1)选择吸附由于溶胶胶核常常选择性地吸附作为稳定剂的某种离子,而使其表面带有电荷。溶胶胶核总是选择吸附与其组成相类似的离子。例如Fe(OH)3溶胶,其胶核吸附稳定剂FeO+CL-中的FeO+而带正电荷。
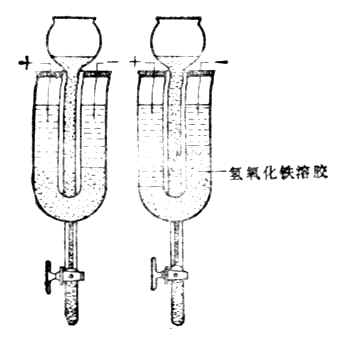

图9-7 氢氧化铁溶胶电泳向负极 图9-8 氢氧化铁胶团结构示意
图α-吸附层,b-扩散层

cl-则留在介质中。
在硫化砷溶胶中,其溶胶胶核吸附HS-而带负电荷。
As2O3+3H2S →As2S3+3H2O
H2S
H++HS-
H+留在介质中。
(2)表面分子离解 胶体粒子与分散介质接触后,表面上的分子与介质作用而离解,某种离子将扩散到介质中去,因此胶体粒子带有和扩散离子符号相反的电荷。例如,硅胶的胶粒是由很多SiO2分子组成的。粒子表面上的SiO2分子和水接触形成硅酸H2SiO3,随后离解生成了SiO32-和H+,H+扩散到介质中成为反离子,胶体粒子则因保留有SiO32-而带负电荷。
3.胶团结构
现以Fe(OH)3溶胶为例来说明胶团的结构(图9-8)。
氢氧化铁溶胶是由许多Fe(OH)3分子构成的,其中心部分叫胶核。胶核的外边是由FeO+和一部分CL-所形成的吸附层,胶核和吸附层统称为胶粒。另一部分CL-借扩散作用而分布于离胶核较远处,形成扩散层。带有相反电荷的吸附层和扩散层电荷符号相反,电量相等,所以胶团是电中性的。胶团的结构可用下式表示。

Fe(OH)3胶粒包括胶核(设为m个Fe(OH)3分子组成)和吸附层。胶粒和扩散层合称为胶团,胶团分散在介质中乃是胶体体系。
(二)溶胶的稳定性和聚沉
由于溶胶是高度分散的多相体系,胶粒有自动聚结的趋势,是一个聚结不稳定体系。但在某种条件下,它又具有聚结的稳定性,胶粒并不合并变大。决定聚结稳定性的主要因素是溶胶胶粒表面的双电层结构,它使胶粒在碰撞时不致相互接触,同时双电层有水化离子,好像胶粒外面包上一层水化膜或溶剂化膜,这层膜就起到阻碍胶粒合并的作用。
凡是使溶胶的分散度降低,分散相颗粒变大,最后从介质中沉淀析出的现象叫聚沉。促使溶胶聚沉的因素有电解质,反电荷的胶体,温度等。溶胶对电解质的影响非常敏感,这是由于电解质中反离子的加入促使胶粒周围的扩散层被“压缩”,扩散层厚度迅速变薄,当电解质的量达到一定程度后,扩散层消失,胶粒变成电中性,同时水化膜也随之消失,这样胶粒就能迅速凝集而聚沉。例如,在氢氧化铁中加入少量K2SO4溶液,溶胶内立即发生聚沉作用,析出氢氧化铁沉淀。
不同的电解质,对溶胶的聚沉能力是不同的,通常用聚沉值来衡量电解质对溶胶聚沉能力的大小。聚沉值是指一定溶胶,在一定时间内完全聚沉所需电解质的最低浓度(mmol·L-1)。聚沉值越小,表示聚沉能力越大。
可以使溶胶聚沉的电解质的有效部分是与胶粒带有相反电荷的离子,这些离子称为反离子。根据叔尔采-哈迪(Schulze-Hardy)规则,反离子的价数越高,聚沉能力也越大。一般说来,一价反离子的聚沉值在25-150之间,二价的约在0.5-2之间,三价的约在0.01-0.1之间。
对于给定的溶胶,反离子为1,2,3价的电解质,其聚沉值的比约为(1/1)6:(1/2)6:(1/3)6。
带有相反电荷的不同溶胶,可以相互聚沉。例如,将带有正电荷的氢氧化铁溶胶和带负电荷的As2S3溶胶混合,可以相互聚沉。
明矾的净水作用,是利用明矾的水解生成AL(OH)3正溶胶,而与带负电荷的胶体污物发生相互聚沉。
温度对溶胶的稳定性影响不大。温度升高时,由于溶胶的布朗运动增强,溶胶粒子之间的碰撞加剧,使溶胶的稳定性下降。