第六节 T细胞基因的转录激活及其表达
TCR/CD3复合物与配体结合后,经多种信号转导途径传递信号,最终导致T细胞活化和增殖。信号转导中所涉及的基因根据其活化时间可以分为早早期、早期、晚期基因三种类型(表8-5)。早早期基因的转录不需蛋白的合成,而早期及晚期基因的转录则需蛋白的合成。早早期及早期基因转录在有丝分裂期之前,而晚期基因转录在有丝分裂期之后。根据活化T细胞内转录的基因表达蛋白功能的不同,活化T细胞基因可以分为以下三种类型:(1)细胞原癌基因;(2)细胞因子基因;(3)细胞因子受体基因。
表-8-5 活化T淋巴细胞表达的基因产物
| 名 称 | 功能范围 | 最早检测mRNA的时间 | 基因产物存在部位 | 活化后增加倍 数 |
| 早早期 | ||||
| c-fos | 核结合蛋白 | 15min | 胞核 | <100 |
| c-myc | 核结合蛋白 | 30min | 胞核 | 20 |
| NF-AT | 核结合蛋白 | 20min | 胞核 | 50 |
| NF-κB | 核结合蛋白 | 30min | 胞核 | >10 |
| 早 期 | ||||
| TFN-γ | 细胞因子 | 30min | 分泌 | >100 |
| IL-2 | 细胞因子 | 45min | 分泌 | >1000 |
| TGF-β | 细胞因子 | ≤2hr | 分泌 | >10 |
| IL-2R(p55) | 细胞因子受体 | 2hr | 浆膜 | >50 |
| IL-3 | 细胞因子 | 1~2hr | 分泌 | >100 |
| LT | 细胞因子 | 1~3hr | 分泌 | >100 |
| IL-4 | 细胞因子 | <6hr | 分泌 | >100 |
| IL-5 | 细胞因子 | <6hr | 分泌 | >100 |
| IL-6 | 细胞因子 | <6hr | 分泌 | >100 |
| Tf-R | 受体 | 14hr | 浆膜 | 5 |
| c-myb | 细胞癌基因 | 16hr | 胞核 | 100 |
| GM-CSF | 细胞因子 | <20hr | 分泌 | - |
| 晚 期 | ||||
| HLA-DR | MHC-Ⅱ类分子 | 3~5d | 浆膜 | 10 |
| VLA-1 | 粘附分子 | 7~14d | 浆膜 | - |
一、细胞原癌基因
细胞原癌基因是一种正常细胞基因,它们的产物存在于细胞的不同部位,参与细胞的生长和分化,这些细胞基因研究室所以称为细胞原癌基因,是因为这些基因的过分表达或其基因的突变形式的表达可以导致细胞恶性增生。T细胞在经TCR/CD3介导的刺激后,几种细胞原癌基因转录水平明显升高,而且许多非淋巴细胞类型在相应配体刺激后也表达这些细胞原癌基因。这些基因中研究最多的是c-fos和c-myc,它们都属于早早期基因范围。c-fos和c-myc转录本分别在T细胞刺激15min和30min内可以检测到,转录水平分别在1hr和6hr内到达最高水平,这两种细胞原癌基因被认为是通过在细胞核内发挥作用而调节细胞生长。Fos蛋白还参与其它基因的转录调节,包括IL-2基因。Myc蛋白可能对于DNA合成的起始是必需的,但它发挥作用的方式还不清楚。其它细胞原癌基因在T细胞活化后期阶段才转录活化,而且需要其它基因的预先表达,例如c-myb仅在自分泌IL-2刺激T细胞后才转录,Myb蛋白发现于细胞核中,但它的功能还不清楚。
二、细胞因子基因
T细胞中多种细胞因子基因转录水平的TCR/CD3介导的刺激4hr后明显提高。IL-2基因可以作为T细胞活化期间细胞因子基因转录调节的典型,IL-2对于大多数正常T细胞来说是一种自分泌生长因子,因此,其基因的转录调节对于T细胞活化是必需的,IL-2基因在TCR介导的正常T细胞刺激45nim-1hr内开始转录。细胞因子基因转录本RNA水平升高大部分是由于转录的增加,而不是由于RNA降解减少。
[AP-1]转录因子AP-1(activator protien-1)是由Fos(55kDa)和Jun(39kDa)组成的异二聚体,通过亮氨酸拉链(leucine zipper,LZ)与DNA结合。AP-1结合点又称佛波酯(12-0-tet-radecanoyll-phordol-13-acetate,TPA)反应元件(TPa responsive element,TRE),其序列为5`-TGACTCA-3`)。TRE命名是因为TPA可通过活化PKC而诱导AP-1并与AP-1结合位点结合。
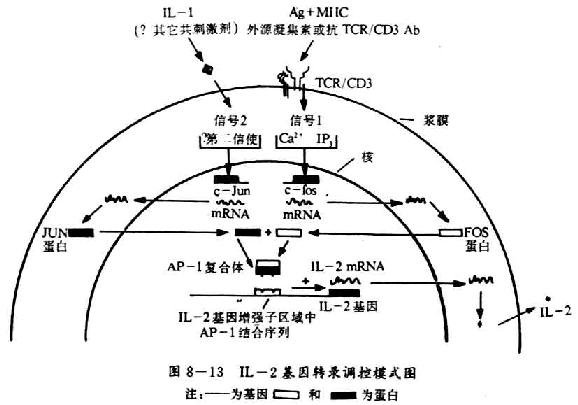
图8-13 IL-2基因转录调控模式图
IL-2基因在转录起始部位的5`端含有一个增强子,它仅存在T细胞中以细胞特异性的方式控制IL-2基因的转录,几种结合到IL-2基因增强子区域的DNA结合蛋白被认为是MHC/Ag结合TCR与IL-2基因转录调节之间重要的联系环节。这个增强子中的一些序列可以特异性地同一个称为AP-1的转录激活蛋白相结合。AP-1可存在于不同细胞类型中,许多不同基因的调节区域都存在AP-1的结合。AP-1可存在于不同细胞类型中,许多不同基因的调节区域都存在AP-1的结合位点,AP-1大部分由c-jun癌基因的蛋白产物组成,但当它同c-fos基因的蛋白产物形成复合物时,其与DNA结合的亲合力大大增加。Fos和Jun是通过多种亮氨酸残基之间的疏水作用即一种“亮氨酸拉链”(lucinezipper)结构结合在一起的,采用某些T细胞肿瘤细胞系分析表明AP-1在IL-2基因转录调节中的作用是非常重要的,采用某些T细胞肿瘤细胞系分析表明AP-1在IL-2基因转录调节中的作用是非常重要的,这些细胞系仅在TCR介导的信号以及IL-1共同作用下才出现IL-2基因的转录。PHA刺激c-fos转录,IL-1刺激c-jun转录,因此,PHA和IL-1可以诱导AP-1核因子的出现(见图8-13)。在正常T细胞中情况更加复杂,IL-2基因的转录可能还需要其它的核因子参与。T细胞中细胞子基因转录的一个明显的特点是它们对免疫抑制药CsA的作用非常敏感,CsA主要是通过抑制T细胞因子的产生起免疫抑制作用的,从而抑制T细胞生长和效应功能,IL-2基因增强子区域是CsA抑制IL-2基因转录的作用位点,推测CsA是干扰一种或多种转录激活DNA结合蛋白的功能。
三 、细胞因子受体基因
IL-2R基因的转录是T细胞活化过程中的重要表现,它对于T细胞自分泌生长是必需的。目前证实IL-2R由三条肽链组成,即α、β、γ链。TCR介导的T细胞刺激可以导致IL-2R亚单位p55(α链)表达升高。IL-2Rα基因有一个5`增强子区域,它可以同PMA诱导的核因子结合。有关IL-2Rβ、γ链的转录调节还不清楚。编码其它细胞因子受体基因(如IL-4R)转录的T细胞受到刺激后也可得到激活,其转录调控方式类似于IL-2R基因。