第四十六章 灭菌法
一、概述
灭菌法是指杀死或除去所有微生物的方法,是灭菌药剂生产的主要过程,对于注射剂尤为重要。微生物包括细菌、真菌、病毒等,凡有生命的地方都有微生物存在,微生物繁殖很快。细菌的芽胞具有较强的的抗热力,不易杀死,因此灭菌效果,应以杀死芽胞为标准。在药剂中选择灭菌方法,与微生物学上的要求不尽相同,不但要达到灭菌的目的,而且要保证药物的稳定性。
二、F与Fo值在灭菌中的意义与作用
近年来对灭菌过程无菌检验中存在的问题引起人们的注意。一方面灭菌温度多系测量灭菌器内的温度不是灭菌物体内的温度,同时无菌检验方法也在局限性。在检品存在微量的微生物时,往往难以用现行的无菌检验法检出。因此,人们对认识到对灭菌方法的可靠性进行验证是很必要的。F(或F)值可作用验证灭菌可靠性的参数。
(一)微生物致死间曲线与D值 人们对微生物死亡的动力学研究表明,其死亡速度属一级过程,在一定温度下符合下述方程(1-1式):
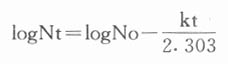
式中N。为原始微生物数,Nt为残存的微生物t时残存的微生物。残存数的对数时间作图,得一条直线,直线的斜率=K/2.303,K为速度常数,单位为时间。为了方便起见,引用D,并定义D为一定温度下杀死被灭菌物品中微生物娄99%所需时间,上式可写成
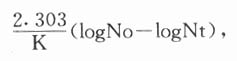
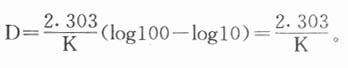
因此,D也可定义为降低微生物一个十位数()或一个对数值(如log100降低到log10)所需的时间,如图46-1所示。D值因微生物的种类、环境、灭菌温度不同而各异(表46-1)。
(二)Z值一旦在不同温度下对特定的微生物的在特定介质或环境中求得D值后,就可用logD值对温度作图,在一定温度范围内,logD与T呈直线关系,直线的斜率=logD2-logD1/T2-T1。
由于此斜率为负值,为避免引入负数,而提出Z值的概念,Z=T-T1/logD2-logD1,故定义Z值为降低一个logD值需的温度数,如图46-2的单位为度,也可以认为Z值是降低微生物数90%所需要的温度数。表46-2是一些药物溶液的Z值
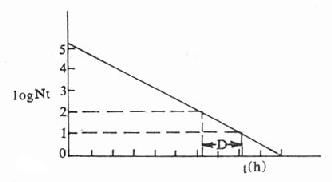
图46-1 logNt与t的关系图
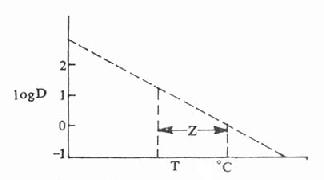
图46-2 logD与T关系图
表46-1 不同灭菌法不同微生物的D值
| 灭菌方法 | 微生物 | 温度 | 介质或样品 | D值(min) |
| 蒸气灭菌 | 嗜热脂肪芽孢杆菌 | 105 | 5%葡萄糖水溶液 | 87.8 |
| 蒸气灭菌 | 嗜热脂肪芽孢杆菌 | 121 | 5%葡萄糖水溶液 | 2.4 |
| 蒸气灭菌 | 嗜热脂肪芽孢杆菌 | 121 | 注射用水 | 3.0 |
| 蒸气灭菌 | 产芽胞梭状芽孢杆菌 | 105 | 5%葡萄糖水溶液 | 1.3 |
| 干热灭菌 | 枯草芽胞杆菌 | 135 | 纸 | 16.6 |
| 红外线灭菌 | 枯草芽胞杆菌 | 160 | 玻璃板 | 18秒 |
表46-2 不同溶液以嗜热脂肪芽孢村菌测定Z值
| 溶液 | Z值℃ |
| 5%葡萄糖水溶液 | 10.3 |
| 注射用水 | 8.4 |
| 5%葡萄糖乳酸盐林格氏溶液 | 11.3 |
| PH7磷酸缓冲液 | 7.6 |
(三)F值与Fo值
1.F值F值的数学表达或可表示如下:
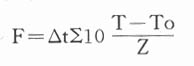
△t是测量被灭菌物温度的时间间隔,一般为0.5-1.0或更小,T是每个△t测量被灭菌的温度,To是参比温度(reference temperature)。
按此表达式,F为在一定温度(T),给Z值所产生的灭菌效力与参比温度(To)给定Z值所产生的灭菌效果相同时所相当的时间(equivalent time)以分为单位。例如干热灭菌的参比温度用170,消毁大肠杆菌内毒素(endotoxin of E.Coli)的Z值为54℃,则采用250℃干热灭菌消毁上述内毒素的F值为750℃分。
根据式(1-1),
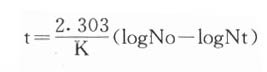
F=DT×(log100-log10-6)
2.Fo值为一定灭菌温度(T)Z值为121℃,并假设特别耐湿热的微生物指示剂(嗜热脂肪芽胞杆菌)的Z值为10℃,则
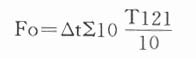
显然,Fo值为一定灭菌温度(T)Z值为10 ℃所产生的灭菌效果力相同时所相当的时间(分)。也就是说Fo是将各种灭菌温度使微生物的致死力转换为灭菌物品完全暴露于121℃使微生物致死效力。
灭菌过程中,只需记录被来菌物的温度与时间,就可算出Fo,假设如下数据,△t取0.5分。
| 时间(min) | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 温度(℃) | 100 | 102 | 104 | 106 | 108 | 110 | 115 | 114 | 115 |
并假设4.0min以后,维持115℃30min不变,则
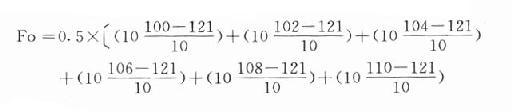
Fo还可以看作P(2)值与微生物的对数降低值的乘积。
Fo=D121×(logNo-logNt)
同样,Nt为灭菌后希望达到微生物残存数,一般取10-6如将含有200个嗜热脂肪芽胞杆菌的5%葡萄糖水溶液以121℃热压灭菌时杀死容器中全部微生物所需要的时间。
Fo值的计算对于验证灭菌效果极为有用,当产品以121℃湿热灭菌时,灭菌器内的温度虽能迅速升到121℃,而被菌物品内部则不然,通过由于包装材料性能及其他因素影响而使。升温度各异,而Fo将随着产品温度(T)变化而呈指数的变化。故温度即使很小的差别(如0.1-1),将对Fo值产生显著的影响。同时要求测定灭菌物品内的实际温度,故用Fo来监测难灭菌效果肯有重要的意义。由于Fo是将不同灭菌温度折算到相当于121℃湿热灭菌时的效力,故Fo值可作为灭菌过程的比较参数。
为了使Fo测定准确,先应选择灵敏度高,重现性好,精密度为0.1的热电偶,并对热电偶进行校验。灭菌时应将热电偶的探针置于被测物的内部,经灭菌器通向柜外的湿度记录仪,有些灭菌记录仪(digistrip recolder)附有Fo计算器,在灭菌过程中和灭菌后,自动显示Fo值。
另外,还应考虑一些其他因素对Fo值的影响,有人对溶液粘度,容器充填量及容器在灭菌器内的数量与排布进行了研究。结果发现对Fo均有影响,而以后者影响最大。故要注意灭菌器内各层、四角、中间位置热分布是否均匀,并进行实际测定,作出合理排布,以便测得Fo值更可靠。
为了确保灭菌效果,还应注意两个问题,根据Fo=D121×(logNo-logNt),若N越大,即被灭菌物中微生物越多,则灭菌时间越长,故生产过程中应尽量减少微生物的污染,应采取各种措施使每个容器的含菌数控制在10以下(即(log10≤1)。其次计算Fo时,应适当考虑增加安全因素,一般增加5%,如规定Fo为8分,则实际操作应控制Fo12分为好。
三、物理灭菌法
(一)干热灭菌法 一般认为繁殖型细胞在100℃以上干热1小时即被杀死。耐热性细菌芽胞在120℃以下长是时间加热也不死亡,介140℃前后则杀菌效率急剧增长。所以,关于干热灭菌条件,有的药典规定为180℃1小时以上,有的药典规定为160-170℃2-4小时,此仅是大至的标准而已,必须通过实验,在保证灭菌完全同时对来菌物品无损害的前提下,制订该物品的干热来菌条件。时间必须由灭菌物品全部达到特定温度的计算。此法适用于耐高温的玻璃制品、金属制品以及不允许湿气透的油脂类和耐高温的粉末化学药品等。热原经250℃30分钟,或200℃以上高温至少45分钟,可遭破坏。消毁大肠杆菌内毒素,250℃时F值为750分,210℃时F值为1950分。本法缺点是穿透力弱,温度不易均匀,而且由于灭菌温度过高,不适用橡胶、塑料及大部分药品。
(二)湿热灭菌法 湿热灭菌法,由于蒸气比热大,穿透力强,容易使蛋白变性,同时还有作用可靠,操作简便等优点,所以是制剂生产中应用最广泛的一种灭菌方法,本法包括热压灭菌法,流通蒸气灭菌法和低温间歇灭菌等方法。根据药品性质进行选用。
1.热压灭菌法 本法一般公认为最可靠的湿热灭菌法。应用大于常压的水蒸气如1kg/cm2热压蒸气以15-20分钟,能杀灭所有细菌增殖体和芽胞。热压灭菌所需的温度及与温度相当的压力及时间如下115.5℃1.7气压(表压力0.71kg/cm2)30分钟;121.5℃2.0气压(表压力11kg/cm2)20分钟;126.5℃2.4气压(表压力1.41kg/cm2)15分钟。湿热灭菌一般要求Fo=1-12分。
热压灭菌用的灭菌器种类很多,但其基本结构大同不异。热压灭菌器密闭耐压,有排气口安全阀,压力表和温度计等部件。有的通蒸气加热,有的用煤气、电热或木炭等加热。常用的有手提式热压灭茵器等。
卧式热压灭菌柜,是一种大型灭菌器,全部用坚固的合金制成,带有夹套的灭菌柜内备有带轨道的格车,分为若干格。灭菌柜顶部装有压力表两只,一只指示蒸气夹套内的压力,另一只指示柜内室的压力。两压力表的中间为温度表,灭菌柜底部装有排气口,在排气管上装有温度探头,以导线与温度相联。国内现已经生产一种有冷却水喷淋装置,灭菌温度与时间采用程序控制的新型热压灭菌器。
热压灭菌器使用时应注意的问题:
(1)灭菌器的构造、被来菌物体积、数量、排布均对灭菌的湿度有一定影响,故应先进行灭菌条件实验,确保灭菌效果。
(2)必须将灭菌器内的空气排出。如果灭菌器内的空气存在,则压力表上所表示的压力是器内蒸气和空气二者的总压而非单纯的蒸气压力。结果压力虽然到达预定的水平,但温度达不到。若表指示一致。则有可能空气没有排尽,也可能压力表失灵,也可能不是饱和蒸气,应找出原因,加以解决。由于水蒸气被空气稀释,妨碍了水蒸气与灭菌物品的充分接触,而降低了水蒸气的灭菌效果。附有真空装置的热压灭菌器,在通入蒸气前将顺内空气抽出,可加快预热过程,缩短灭菌时间。减压还可有效地将多孔性物质中空气驱除,有利于水蒸气的穿透,同时灭菌器内温度均匀。
(3)灭菌时间必须由全部药液温度直正达到所要求的温度时算起,在开始升温时,要求一定的预热时间,例如250-500ml输液瓶,预热时间为15-30分钟。一般灭菌器上,均装有压力表和温度计,但通常是测定灭菌器内的温度,百不是被灭菌物内的温度,因此最限能设计直接测定被灭菌物内温度的装置。同时为了确保灭菌温度,在生产上常使用温度批示剂例如利用某些熔点正好是灭菌所需温度的化学药品作指示,以判断灭菌湿度是否达到。方法是将少量的药物封装于安瓿内,与灭菌物一起放入灭菌器的上下部位灭菌,灭菌后观察药品是否熔化。常用化学药品指示剂有升华硫(115℃)、安替匹林(110-120℃)、碘仿(115℃)、氯基比林(107-109℃)、苯甲酸(121℃)等,并可加着色剂如亚甲蓝、甲紫等以便于观察。但此类指示剂并洋能表明保持该湿度的确切时间。将耐热的芽胞封装于安瓿内浸透于干纸条中,制成生物性指示剂,广泛地地试验灭菌设备及方法。但用于药剂的常规生产中,应使用非致病性、有抵抗力、不产生热原的菌种,如B.Stearothermophilus此外,国内现已采用灭菌温度和时间自动控制记录的装置。
(4)灭菌完毕后,停止加热,一般必须使压力表所指示的压力逐渐下降到零,才能放出锅内蒸气,使锅内压力与大气压相等后,稍稍打开灭菌锅待10-15分钟,再全部打开。这样可避免内外压力差太大而使物品冲出锅外和使玻璃瓶炸裂。这点必须注意,以免发生工伤事故。为了缩短灭菌周期,也有对灭菌器内盛有溶液的容器喷雾水冷却,以加速冷却。实验表明对于经过0.70热压灭菌的200个/升的瓶子,用水温度18℃雾滴大小为80进行喷雾时,冷却效果最大,过冷粗的喷雾将引起瓶子的爆破,或用逐渐降温的喷雾水冷却。对于灭菌后要求干燥但又不易破损的物料,灭菌后立即放出灭菌器内的蒸气,以利干燥。
2.流通蒸气灭菌和煮沸灭菌法 流通蒸气灭菌是不密闭的容器内,用蒸气灭菌。压力与大气压相等。即100℃的蒸气灭菌。目前我国药厂生产注射剂,特别是1-2的注射剂及不耐高热的品种,可考虑采用这种灭菌法。煮沸灭菌法就是把安瓿或其他物品放入水中煮沸灭菌。流通气灭菌与煮沸灭菌,一般是100℃30分钟或60分钟。此法不能保证杀灭所有的芽胞,例如破伤风等厌气性菌的芽胞,故制备过程中要尽可能避免污染,这点必须充分注意。
3.低温间歇灭菌法 此法是将待灭菌的制剂或药品,用60-80℃加热1小时,将其中的细菌繁殖体杀死,然后在室温或孵卵箱中放置24小时,让其中的芽胞发育成为繁殖体,再二次加热将其消灭为止。加热和放置需连续操作三次以上,至全部芽胞消灭为止。此法适用于必须用热法灭菌但又不耐较高温度的制剂或药品。本法的缺点,不仅需要时间长,并且消灭芽胞的效果常不够完全,应用本法灭菌的制剂或药品,除本身具有抑制力者外,须加适量抑菌剂,以增加灭菌效力
4.影响湿热灭菌的因素
(1)微生物的种类和数量:各细菌对热的抵抗力相差很大,处于不同发育阶段,所需灭菌的湿度与时间也不相同,繁殖期的微生物对高温比衰老时期的抵抗力小得多。前面已经指出,每个容器的细菌数,控制在10个以内为宜。最初菌数愈少,达到灭菌时间愈短。同时,最初菌数增多也增加了耐热个体出现的几率。即使细菌全部杀灭,而注射液中细菌体过多,亦会引起临床上的不良反应,所以整个性产过过程应尽可能避免微生物污染,尽可能缩短生产过程,并力求在灌封后立即菌。
(2)注射液的性质:注射液若含有营养物质,如糖类,蛋白质等,对微生物可能有一种保护作用,能增强其抗热性。此外,药液pH对细菌的活性也有影响。一般微生物在中性液中耐热性最大,在碱性溶液中次之;酸性不利于微生物的发育。所以,一般在生物碱盐类的注射液,因ph 较低,用流通蒸气灭菌即可。加有适当抑菌剂时,药液经100℃30分钟加热,可杀死抵力强芽胞。有些药典采用此种灭菌方法所用的抑菌剂为甲酚(0.1-0.3%)、氯甲酚(0.05%-0.1%)、苯酚(0.1%-0.5%)、三氯叔丁醇(0.2%-0.5%)、硝酸苯汞或醋酸苯汞(0.001%-0.002%)。
(3)药物的稳定性:
温度增高,化学反应速度增加:时间愈长,起反应的物质愈多。因此,不能只看到灭菌杀死细菌的一面,也要看到保证药物有效性的一面。为此在能达到灭菌的前提下,可适当降低湿度或缩短时间。实践证明在力求避免微生物污染和严格质量控制的条件下,维生素C注射液用流通蒸气15分钟灭菌,氯化钠注射注用115℃30分钟是可行的。
(三)紫外线灭菌法 一般用于灭菌的紫外线波长是200-300nm,灭菌力最强的是波长为254nm4的紫外线。紫外线进行直线传播,其强度与距离平方成比例地减弱,并可被不同的表面反射。其穿透作用微弱,但较易穿透清洁空气及纯净的水,其中悬浮物或水中盐类增多时,则穿透程度显著下降。所以紫外线广泛作空气灭菌和表面灭菌之用。一般在6-15m3的空间可装置30瓦(或36-48)紫外线灯一只,灯距离地面以2.5m到3m为宜。湿度过大可降低灭菌效果,相对湿度以45%-60%比较适宜。湿度宜于10-55℃范围。紫外线灯管秘须保证无尘油垢,否则辐射强度将大力为降低。普通玻璃可吸收紫外线。因此安瓿中药物不能用此法灭菌。
紫外线的杀菌效率,还取决于微生物的敏感性。如于一平面上辐射强度为通常应用的最小强度2mw/cm2(30瓦紫外线灯于距1米处强度为85mw/cm2)时杀死枯草杆菌芽胞需1100秒,而对溶血性链球菌,则仅需275秒。可粗略认为在紫外线灯下直接暴露,一般繁殖型微生物约3-5分钟,芽胞约10分钟即可死亡。唯紫外线对酵母特别是霉菌杀菌力较弱。紫外线对人体如照射过久,能产生结合膜炎及皮肤烧灼等现象。一般均在操作前启紫外线灯约半小时至一小时,然后进行操作。各种规格的紫外线灯,皆规定了有效使用时即,一般为3,000小时。故每次使用应登记开启时间,并定期进行来菌效果的检查,也可用具有对254nm灵敏的照度计,来测定其辐射强度。
(四)过滤除菌法 过滤除菌法,是使药物溶液通过无菌的特定滤器,除去活的或死的微生物而得到不含微生物的滤液。适于很不耐热的药液的灭菌。供来菌用的滤器。要球能有效地从溶液中除净微生物,溶液顺畅地由滤器通过,滤液中不落入任何所不需要的物质,滤器容易清洗,操作简便。
繁殖型细菌很少有小于1μm者,芽胞大小为0.5μm或更小些,所以,对于以过筛作用滤过的滤器,例如纤维素酯膜滤器。其孔径大秘须小到足以阻止细胞和芽进入滤孔之内,大约为0.2μm。靠阻留于孔道之内或静电作用的滤器,孔径可稍大于所要滤除的颗粒,但如压力过大或波动,颗粒有被挤过的可能。滤孔径要进行检查,最常用测定孔径的方法,是用大小为0.7μm左右的灵菌(Bprodigiosus)混悬液滤过,滤液通过培养试验,观察有无灵菌滤过。
近年来广泛采用微孔薄膜作灭菌滤器,膜滤器的性能详见注射剂一章滤器的种类与选择项下,作灭菌过滤一般选用孔径0.22μm的滤膜。G6号垂熔玻璃漏斗,其滤孔直径在2μm以下,可以除去细菌,对药物不吸附,也不影响药液的pH,常灭菌滤器。此外孔径0.8-1.8μm的石棉板滤器孔径1.5-1.7μm的白陶土滤柱,也可作滤过细菌用,但由于它们存在一些缺点,所以实际使用不多。
(五)辐射灭菌法 辐射灭菌是应用γ射线杀菌的方法。γ射线通常可由放射性同位素如Co60产生。辐射灭菌的特点是可不升高的产品的温度,特点用于某些不耐热的灭菌,穿透性强,γ射线适用于较厚样品的灭菌,现已成功地应用于某些物质如维生素类、抗菌素、激素、肝素、羊肠线、医疗器械等物质的灭菌。包装的产品也可灭菌而大大减少了污染的机会。灭菌剂量一般用2.5兆拉得(Megarad),此法,已为《英国药典》(1969)日本药典Ⅸ所收载。
辐射灭菌,设备费用高,某些药品经辐射灭菌后,有可能效力降低,产生毒性物质或发热性物质,且溶液不如固体稳定,同时要注意全防护问题。
(六)微波灭菌法、高速风灭菌法 通常所谓微波,是指频率在300兆赫到300千兆赫之间的电磁波。水可强烈地吸收微波,使极性分子转动,由于分子间的摩擦而生热。热是在被加热的物质内产生的,所以加热很均匀,并且升温迅速。同时,由于微波可穿透介质较深,所以在一般情况下,可以作到表里一致地均匀加热。微波所以用于水性注射的灭菌,主要是由于其产生热效应的缘故。
微波灭菌法含菌量高达350万个大肠杆菌的生理盐水混悬液,密封在1-2ml的安瓿中,经3-5千瓦功率,2450兆赫的微波作用15秒钟以上,安瓿温度接近110℃左右时,可将细胞细菌全部杀灭。金黄色葡萄球菌与此结果近似,枯草杆菌芽胞,含量为6万-8万个时,液温必须达到140℃,保持20秒钟以上。才能彻底杀灭,含2,000-3,000个青菌胞子的生理盐水混悬液,在3-4千瓦微波功率作用下,液温达到120℃以上,经20-25秒钟,即彻底杀灭。经过微波灭菌后的安痛定、维生素、维生素C、速尿、庆大霉素、卡那霉素注射液。除维生素C的溶液色泽有部分变黄外,其他五种的色泽、pH和主要成份含量都无明显变化。宇野等还比较了微波灭菌与高蒸气灭菌对17种化学药物稳定的影响,认为对高压蒸气灭菌稳定的药物,使用微波灭菌时无变化,而对高压蒸气灭菌不稳定的药物如维生素C,阿司匹林等用微波灭菌,则比较稳定,其分解程度降低。此法由于存在破损率高,灭菌不完全及劳动保护等问题,还有待进一步研究。
高速风灭菌法,应用的风速为30-80m/秒,风温度高为190℃,由于降低了安瓿周围的滞流层的厚度,使安瓿内液体迅速升温。2ml的安瓿注射液应用此法,能于3分外的短时间内升高至140℃,对于耐热性高的嗜热脂肪芽胞杆菌,液温度达到130℃以上,就呈现显著灭菌效果。与热压蒸气灭菌法比较,不但具不同等以上的灭菌效果,并使注射液变质较少。因此,作者认为高速热风菌法,对于小容量安瓿注射液的灭菌极为不利。
此外还有超音波灭菌法,仅用于疫苗制品。
四、化学灭菌法
本法是指用化学药品直接作用于微生物而将其杀死,同时不应损害制品的质量,常用的方法有:
(一)气体灭菌法 制药工业上用于菌的气体,多用环氧乙烷。环氧乙烷的分子式为:
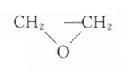
,沸点为10.9℃,室温下气,在水中溶解度很大,1ml水中可溶195ml(20℃,760mmHg),易穿透塑料,纸板及固体粉末,暴露于空气中环氧乙烷就可从这些物质消散,环氧乙烷对大多数固体呈惰性。环氧乙烷的杀菌作用,由于其为烷化剂的性质,使菌体蛋白的-COOH,-NH2,-SH,-OH,的H,被-CH2-CH2-OH所换。可用以灭菌塑料容器,对热敏感的固体药物,纸或塑料包装的药物,橡胶制品、注射筒,注射针头,衣着敷料及器械等。但是,一些塑料、皮革及橡胶与环氧乙烷有强亲和力,故需长达12-24小时通空气驱除。我国曾用环氧乙烷对苄霉素普鲁卡因进行灭菌,效果良好。
环氧乙烷具可燃性,当与空气混合,空气含量达3.0%(v/v)时即可爆炸。故应用时需用惰性气体二氧化碳或氟利昂稀释。环氧乙烷的吸入毒性较大与氨相近,无氨样的剌激嗅味,损害皮肤及眼粘膜,可产生水泡或结膜炎,故应用时要注意。
用环氧乙烷来菌的程序,大致为将灭菌物品置于灭菌器内后,减压排除空气,预热,环氧乙烷采用混合气,一般用环氧乙烷12%氟利昂88%或用环氧乙烷10%二氧化碳90%,在减下输入混合气,保持一定浓度、湿度、及温度,以过一定时间后,抽真空排除环氧乙烷,然后送入无菌空气完全排除环氧乙烷的浓度为850-900mg/L(3小时、45℃)45mg/L(5小时,45℃),相对湿度以40%-60%为宜湿度为22-55℃。
在药剂工作中,也常利用一些化学药剂的蒸气熏蒸,进行操作室内的灭菌。甲醛溶液加热熏蒸,每立方米空间用40%甲醛溶液30m1室内相对湿度宜高,以增进甲醛气体灭菌效果。甲醛对粘膜有强性激性,灭菌后剩余的甲醛气体可排除或通入氨予以吸收。亦有采用丙二醇作室内空气灭菌者,丙二醇具有不挥发性和无引火性等特点,灭菌用量为1ml/m3,将丙二醇置蒸发器中加热,使蒸气弥漫全室。也有用乳酸蒸气灭菌者用量为2ml/m3,杀菌力虽不及甲醛,但对人无害,此外,还有使用三甘醇(Triethyeneglyool HO-(CH2)2-O-(Ch2)2-O-(Ch2)2-OH)的,三甘醇是无色粘稠液体,沸点285℃,溶于水使用方法与丙二醇同,也有报导,过酣酸用于车间的室内菌,效力比相同浓度的甲醛大两倍半,对粘膜,眼部无剌激性,对木制品、金属制品、医疗器械均无影响。
(二)应用化学杀菌剂 在制剂工业上应用化学杀菌剂,其目的在于减少微生物的数目,以控制无菌状况至一定水平。化学杀菌剂并不能杀死芽胞,仅对繁殖体有效。化学杀菌剂的效果,依赖于微生物的种类及数目,物体表面光滑或多孔与否,以及化学杀菌剂的性质。常用的有0.1%-0.2%新洁而来溶液,2%左右的酚或煤酚皂溶液75%酒精等。由于化学杀菌剂常施用于物体表面,也要注意其浓度不要过高,以防其化学腐蚀作用。
五、无菌操作法
无菌操作法在技术上并非灭菌操作,因其与灭菌操作有密切联系,而于本节内讨论。
无菌操作法,是整个过程控制在无菌条件下进行的一种操作方法。某些药品加热灭菌后发生变质、变色或降低含量者可采用无菌操作法制备。此种无菌操作,不仅用于注射剂而且对其它的如滴眼剂、海棉剂等用于粘膜和创伤的制剂也均适用。无菌操作室或无菌操作所用的一切用具、材料以及环境,均须应用面所述灭菌法灭菌,操作须在无菌操作室或无操作柜内进行。
(一)无菌操作的空气灭菌可应用上节《气体灭菌法》中所述的甲醛、丙二醇、乳酸、三甘醇等。其具体用法不再赘述。药厂大型无菌操作,常用甲醛溶液加热熏蒸进行空气灭菌。将甲醛溶液放入瓶内,逐渐被吸收蒸气夹层加热锅中,甲醛溶液被加热,甲醛蒸气经气出口送入总进风道,由鼓风机吹入无菌操作室,连续3小时后,一般即可将鼓风机关闭。室温应保持25℃以上,以免室温过低甲醛蒸氯了聚合而附着于冷表面,湿度应保持60%以上,密闭熏蒸12-24小时以后,再将25%氨水加热(每m3用8-10ml),从总风道送入氨气约15分钟,以吸收甲醛蒸气,然后开启总出口排风,并通入经处理过的无菌空气直到室内无臭气为止。
除用上述方法定期进行较彻底的灭菌外,还要对室内的空间、用具(桌椅等)、地面、墙壁等,用3%酚溶液、2%煤酚皂溶液、0.2%新洁而或75%酒精喷洒或擦试。其它用具尽量用热压灭菌法或干热灭菌法灭菌。每天工作前开启外线一小时,中午休息时间也要开1/2-1小时。
(二)无菌操作 操作人员进入操作之前要洗澡并换上已经灭菌的工作服和清洁的鞋子,不使头发、内衣等露出来,以免造成污染机会。安瓿要150-180℃2-3小时干热灭菌。橡皮塞要以121℃1小时热压灭菌。有关器具、机器都要经过灭菌。用无菌操作法制备的注射剂,大多要加入抑制。
小量无菌制剂的制备,也可在无菌操作柜中进行。无菌操作柜分小型无菌操作与联合无菌无操作两种小型无菌操作柜又称单人无菌柜。式样有单面式与双面式两种。操作柜的架子用木制,四周配以玻璃,前面操作下装木板,挖二圆孔,孔内密接橡皮手套或袖套。药品及用具等,由侧门送入柜内后关闭。操作时可完全与外界空气隔绝。柜内空气的灭菌,可在柜中央上方装一小型紫外线灯,使用前1小时启灯灭菌,或用药液(如3%酚溶液)喷雾灭菌。联合无菌操作柜是由几个小型操作柜联合制成,以使原料的精制,传递分装及成品暂时存放等工作全部在柜内进行。近年来,采用层流洁净工作台作无菌操作,使用方便,效果可靠。
六、无菌检查法
药剂或药品经灭菌或无菌操作法处理后,需经无菌检验证实已无微生物生存,方能作用。
法定的无菌检查法,包括有试管接种法和薄膜过滤法,其具体操作方法以及在一些特殊情况下的变动,可详见《中国药典》附录中的无菌检查法。薄膜过滤用于无菌检查的突出优点,在于可滤过较大量的样品可滤除抑菌性物质,滤过后的薄膜,即可直接接种于培养基管中,或直接用显微镜观察,故此法灵敏度高,不易产生假阴性结果,检测次数减少,节省培养基,操作比较简单。