第三节 酶的分子组成和化学结构
一、酶的分子组成
根据酶的组成成份,可分单纯酶和结合酶两类。
单纯酶(simpleenzyme)是基本组成单位仅为氨基酸的一类酶。它的催化活性仅仅决定于它的蛋白质结构。脲酶、消化道蛋白酶、淀粉酶、酯酶、核糖核酸酶等均属此列。
结合酶(conjugatedenzyme)的催化活性,除蛋白质部分(酶蛋白apoenzyme)外,还需要非蛋白质的物质,即所谓酶的辅助因子(cofactors),两者结合成的复合物称作全酶(holoenzyme),即:
| 全酶 | =酶 蛋 白 | + 辅助因子 |
| (结合蛋白质) | (蛋白质部分) | (非蛋白质部分) |
酶的辅助因子可以是金属离子,也可以是小分子有机化合物。常见酶含有的金属离子有K+、Na+、Mg2+、Cu2+、(或Cu+)、Zn2+和Fe2+(或Fe3+)等。它们或者是酶活性的组成部分;或者是连接底物和酶分子的桥梁;或者在稳定酶蛋白分子构象方面所必需。小分子有机化合物是些化学稳定的小分子物质,其主要作用是在反应中传递电子、质子或一些基团,常可按其与酶蛋白结合的紧密程度不同分成辅酶和辅基两大类。辅酶(coenzyme)与酶蛋白结合疏松,可以用透析或超滤方法除去;辅基(prostheticgroup)与酶蛋白结合紧密,不易用透析或超滤方法除去,辅酶和辅基的差别仅仅是它们与酶蛋白结合的牢固程度不同,而无严格的界限。
现知大多数维生素(特别是B族维生素)是组成许多酶的辅酶或辅基的成分(见表2-1)。它们的化学结构式见生物氧化章。体内酶的种类很多,而辅酶(基)的种类却较少,通常一种酶蛋白只能与一种辅酶结合,成为一种特异的酶,但一种辅酶往往能与不同的酶蛋白结合构成许多种特异性酶。酶蛋白在酶促反应中主要起识别底物的作用,酶促反应的特异性、高效率以及酶对一些理化因素的不稳定性均决定于酶蛋白部分。
表2-1 B族维生素及其辅酶形式
| B族维生素 | 辅酶形式 | 主要作用 |
| 硫胺素(B1) | 硫胺素焦磷酸酯(TPP) | α-酮酸氧化脱羧酮基转换作用 |
| 硫辛酸 | 6,8-二硫辛酸 | α-酮酸氧化脱羧 |
| 泛酸 | 辅酶A(CoA) | 酰基转换作用 |
| 核黄素(B2) | 黄素单核苷酸(FMN) 黄素腺嘌呤二核苷酸(FAD) | 氢原子转移 氢原子转移 |
| 尼克酰胺(PP) | 尼克酰胺腺嘌呤二核苷酸(NAD+) 尼克酰胺腺嘌呤二核苷酸磷酸(NADP+) | 氢原子转移 氢原子转移 |
| 吡哆素(B6) | 磷酸吡哆醛 | 氨基酸代谢 |
| 生物素(H) | 生物素 | 羧化作用 |
| 叶酸 | 四氢叶酸 | “一碳基团”转移 |
| 钴胺素(B12) | 5-甲基钴铵素 5-脱氧腺苷钴铵素 | 甲基转移 |
二、酶的分子结构和活性中心
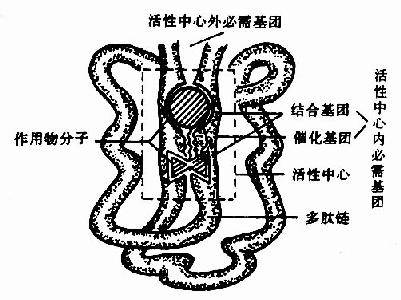
图2-1 酶活性中心示意图
酶的分子中存在有许多功能基团例如,-NH2、-COOH、-SH、-OH等,但并不是这些基团都与酶活性有关。一般将与酶活性有关的基团称为酶的必需基团(essentialgroup)。有些必需基团虽然在一级结构上可能相距很远,但在空间结构上彼此靠近,集中在一起形成具有一定空间结构的区域,该区域与底物相结合并将底物转化为产物,这一区域称为酶的活性中心(active center),对于结合酶来说,辅酶或辅基上的一部分结构往往是活性中心的组成成分。
构成酶活性中心的必需基团可分为两种,与底物结合的必需基团称为结合基团(binding group),促进底物发生化学变化的基团称为催化基团(catalyticgroup)。活性中心中有的必需基团可同时具有这两方面的功能。还有些必需基团虽然不参加酶的活性中心的组成,但为维持酶活性中心应有的空间构象所必需,这些基团是酶的活性中心以外的必需基团。
酶分子很大,其催化作用往往并不需要整个分子,如用氨基肽酶处理木瓜蛋白酶,使其肽链自N端开始逐渐缩短,当其原有的180个氨基酸残基被水解掉120个后,剩余的短肽仍有水解蛋白质的活性。又如将核糖核酸酶肽链C末端的三肽(棻麠丝楃?切断,余下部分也有酶的活性,足见某些酶的催化活性仅与其分子的一小部分有关。
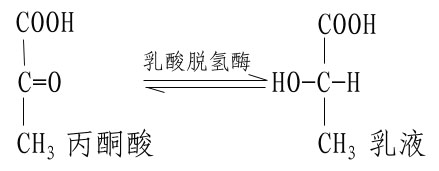
不同的酶有不同的活性中心,故对底物有严格的特异性。例如乳酸脱氢酶是具有立体异构特异性的酶,它能催化乳酸脱氢生成丙酮酸的可逆反应:
L(+)乳酸通过其不对称碳原子上的桟H3、桟OOH及桹H基分别与乳酸脱氢酶活性中心的A、B及C三个功能基团结合,故可受酶催化而转变为丙酮酸。而D(-)乳酸由于桹H、桟OOH的空间位置与L(+)乳酸相反,与酶的三个结合基团不能完全配合,故不能与酶结合受其催化(图2)。由此可见,酶的特异性不但决定于酶活性中心的功能基团的性质,而且还决定于底物和活性中心的空间构象,只有那些有一定的化学结构,能与酶的结合基团结合,而且空间构型又完全适应的化合物,才能作为酶的底物。
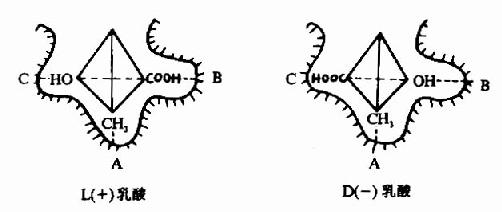
图2-2 乳酸脱氢酶的立体异构特异性
A、B、C分别为LDH活性中心的三个功能基团
但是,酶的结构不是固定不变的,有人提出酶分子(包括辅酶在内)的构型与底物原来并非吻合,当底物分子与酶分子相碰时,可诱导酶分子的构象变得能与底物配合,然后底物才能与酶的活性中心结合,进而引起底物分子发生相应化学变化,此即所谓酶作用的诱导契合学说(induced fit theory)。用X衍射分析的方法已证明,酶在参与催化作用时发生了构象变化。
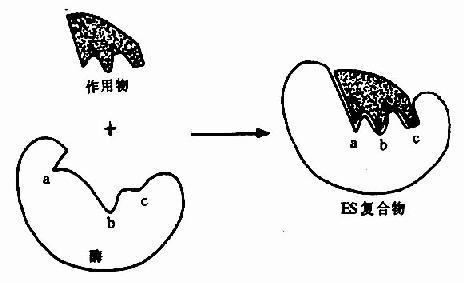
图2-3 底物与酶相互作用的“诱导契合”模式图