第四节 心力衰竭的发病机制
心力衷竭的本质是心肌收缩性减弱。为了理解有关的问题,本节将首先简要地复习心肌收缩的分子生物学基础,然后讨论心力衰竭的一般发病机制,以及肥大心肌转向衰竭的机制。
心肌的收缩物质是组成粗、细肌丝的心肌蛋白。粗肌丝的主要成分是肌球蛋白(myosin),其分子量约50万,全长1500A,一端为杆状的尾部,另一端为粗大的头部(S1),二者之间是能弯曲的颈部(S2)。头部又分成两片,是ATP酶的活动中心,它在肌动蛋白和肌球蛋白之间的搭桥和粗细肌丝之间的滑行中起着重要作用。细肌丝的主要成分是肌动蛋白(actin),分子量47.000,分子呈球状,串联而成双链螺旋状的细肌丝纤维。在双链间的沟槽内,杆状的向肌球蛋白(tropmyosin)和肌动蛋白卷曲在一起,每距400A处还有一个肌钙蛋白(troponin)分子。向肌球蛋白和肌钙蛋白是调节蛋白,本身不起收缩作用,但能调节肌动蛋白与肌球蛋白的联结,而使心肌纤维发生收缩和舒张。肌钙蛋白由三个亚单位组成,即向肌球蛋白亚单位(tropotroponin,TnT)、抑制亚单位(inhibrtor troponin,TnI)钙结合亚单位(calciumcombining troponin, TnC)在心肌兴奋-收缩偶联中起重要作用(图12-1、2)。
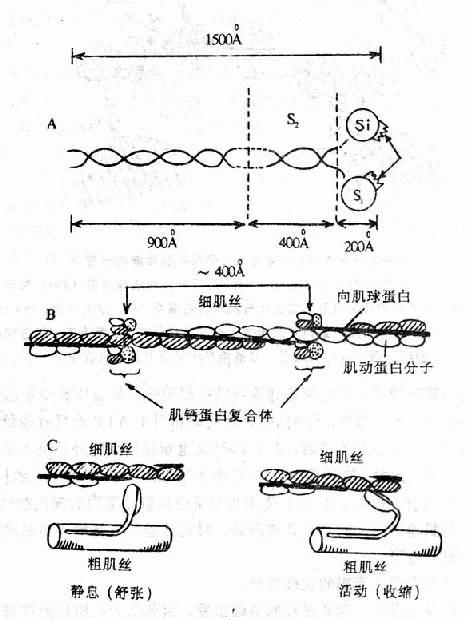
图12-1 心肌收缩蛋白和调节蛋白
A.肌球蛋白分子结构模式图,说明见正文。
B.肌动蛋白分子呈球形,串联而成双链螺旋状的细肌丝。
向肌球蛋白在两个肌动蛋白链之间。
每隔400A有一肌钙蛋白复合体。
C.示粗、细肌丝在收缩与舒张时的相互关系。
Ca2+在心肌兴奋时的电活动与机械收缩之间起偶联作用。当心肌除极化时,Ca2+从细胞外转移到心肌细胞的胞质中,同时也从肌质网释放入胞质。因此胞质内Ca2+浓度升高(由10-8M升至10-5M)。此时肌钙蛋白的TnC即迅速与Ca2+结合。这种结合相继使TnC和TnI的构型发生变化,其结果是TnI从肌动蛋白移开。这种构型变化又可通过TnT影响向肌球蛋白的位置,使向肌球蛋白旋转到肌动蛋白两条螺旋状链的深沟中,从而使肌动蛋白的受点暴露而与肌球蛋白头部相接触,形成横桥。S1的ATP酶随即作用于ATP而释放能量,肌动球蛋白(actomyosin)乃发生收缩。心肌收缩后,由于Ca2+又重新移到细胞外及进入肌质网,胞质内Ca2+浓度又降至10-8M。此时,肌钙蛋白的TnC失去了Ca2+,TnC和TnI的构型恢复原状,故TnI又与肌动蛋白结合,进而通过TnT使向肌球蛋白从肌动蛋白的深沟中转移出来,而恢复原来的位置。于是肌动蛋白上的受点又被掩盖,肌动球蛋白重新解离为肌动蛋白和肌球蛋白,横桥解除,心肌乃舒张。

图12-2 Ca2+与肌钙蛋白结合引起心肌收缩的示意图
在舒张期(左),肌钙蛋白复合体三成分(I、C、T)使向肌球蛋白
(Tm)位于细肌丝(A)螺旋沟的外侧,从而阻止细肌丝与肌球蛋白
横桥(M)发生作用。当Ca2+与肌钙蛋白C(右)结合引起一系列的
活动使I与细肌丝分开、从而使Tm移进细肌丝的螺旋沟中,细肌丝乃得
以与肌球蛋白横桥相互作用而引起心肌收缩。
下文将着重讨论慢性心力衰竭的发病机制。
从心肌分子结构及兴奋收缩偶联过程的基础出发,目前认为心肌负荷过重和心肌受损等病因引起心肌收缩性减弱的一般机制大致有下述几个方面。
一、心肌能量代谢障碍
(一)能量生成(释放)障碍
心肌主要借各种能源物质包括脂肪酸,葡萄糖等的有氧氧化而获得能量。心肌细胞对氧的需要量很大,摄取能力很强,在正常安静情况下,冠状动静脉血氧含量差可高达14ml%。可见,心肌氧供给不足或有氧氧化过程的障碍,均可使心肌细胞内能量生成不足而导致心肌收缩性减弱。
严重的贫血、冠状动脉硬化等所引起的心肌缺氧,是导致心肌细胞内能量生成不足的常见原因。维生素B1缺乏时,由于焦磷酸硫胺素(丙酮酸脱羧酶的辅酶)生成不足,丙酮酸的氧化发生障碍,故也可引起心肌能量生成不足。肥大的心肌也可因心肌缺氧而导致能量生成不足(详后文)。
(二)能量利用障碍
心肌细胞内氧化磷酸化过程中所产生的ATP,在心肌兴奋-收缩偶联过程中受到肌球蛋白头部ATP酶的作用而水解,为心肌收缩提供能量。实验表明,部分动物的心肌由肥大转向衰竭时,心肌耗氧量和ATP含量并不减少而完成的机械功却显著减少,说明心肌利用ATP中的化学能作机械功的过程有障碍,即心肌的能量利用发生障碍。有人发现,随着心肌负荷过重而发生心肌肥大时,心肌收缩蛋白的结构发生变化,肌球蛋白头部ATP酶的活性降低,ATP水解发生障碍,因此能量利用发生障碍,心肌收缩性乃因而减弱。这种现象也可见于老年人及甲状腺功能低下的心脏。关于心肌收缩蛋白质结构发生变化的机制尚未阐明。
二、兴奋-收缩偶联障碍-Ca2+的运转失常
近年来,在心力衰竭的发病机制中,因Ca2+运转失常引起的心肌兴奋-收缩偶联障碍,受到了很大重视。正常心肌在复极化时,心肌细胞内肌质网的ATP酶(钙泵)被激活,从而使胞质中的Ca2+逆着浓度差被摄取到肌质网中储存;同时,另一部分Ca2+则从胞质中被转运到细胞外。于是心肌细胞胞质Ca2+浓度降低。心肌舒张。心肌除极化时,肌质网向胞质释放Ca2+,同时又有Ca2+从细胞外液进入胞质,因而胞质中Ca2+浓度增高,心肌收缩。心肌兴奋-收缩偶联障碍的发生机制主要有:
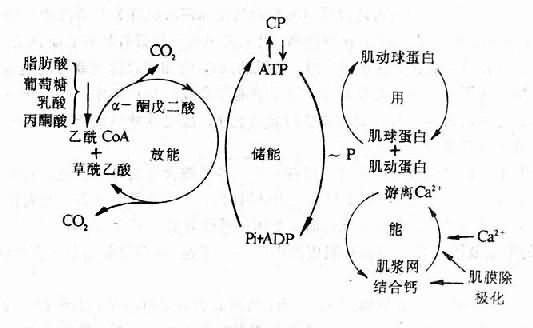
图12-3 心肌能量代谢
(一)肌质网摄取Ca2+减少有人发现,在过度肥大的心肌中,肌质网ATP酶的活性降低,因而在心肌复极化时肌质网摄取和储存Ca2+的量减少,除极化时肌质网向胞质释放的Ca2+也因之减少。由此所引起的心肌细胞除极化时胞质内Ca2+浓度的低下可能是心肌收缩性减弱的重要原因。
另据报道,在肌质网摄取Ca2+减少的同时,线粒体对Ca2+摄取量增多,但线粒体在心肌除极化时向胞质释放Ca2+的速度却非常缓慢。Ca2+在心肌细胞中这种异常的分布也是胞质Ca2+浓度降低的一个原因。此外,还有人认为线粒体内Ca2+的增多可引起氧化磷酸化脱偶联,从而使能量生成不足。
(二)酸中毒和高钾血症 Ca2+的运转也受H+和K+的影响。在心力衰竭时有一定程度的缺氧,故可有细胞外液H+和K+浓度的增高。关于H+如何影响运转的问题也未完全清楚。不同的作者提出过不同的假设:Katz等曾认为H+能在肌钙蛋白上与Ca2+竞争结合位置,因而在H+过多时就能取代Ca2+的位置而使心肌的兴奋-收缩偶联发生障碍。也有人报道,在H+浓度增高时,Ca2+与肌质网的结合比较牢固,除极化时肌质网释放Ca2+减少,故H+增多时,心肌的兴奋-收缩偶联发生障碍。前文已经提到,正常心肌细胞在除极化时有Ca2+从细胞外液进入胞质,而最近有人报道,在细胞外液H+浓度增高时,Ca2+的内流减慢,故心肌兴奋-收缩偶联发生障碍。
细胞外液中的K+和Ca2+在心肌细胞上有互相竞争的作用。当外液中K+浓度升高时,动作电位中Ca2+内流就减少,因而心肌胞质中Ca2+浓度降低,这也是引起心肌兴奋-收缩偶联障碍的一个因素。
(三)心肌内去甲肾上腺素含量减少有人报道,从心力衰竭患者取得的心房活组织中。去甲肾上腺素的含量很低:从有严重心力衰竭而行二尖瓣置换术的患者取得的心室乳头肌活组织中,去甲肾上腺素的含量也很少,在有的病人,含量仅为正常的10%。心力衰竭时心肌去甲肾上腺素含量减少,可能是由于肥大而衰竭的心肌中酪氨酸羟化酶活性降低,因而心肌交感神经纤维中儿茶酚胺的合成减少所致。在正常情况下,去甲肾上腺素与心肌细胞表面的β受体结合后,通过激活腺苷酸环化酶,可使心肌细胞内的ATP转变为cAMP,cCAMP一方面能促使Ca2+内流,另一方面又可通过蛋白激酶的活化而使心肌细胞肌质网的一种蛋白磷酸化,从而使肌质网摄取和释放Ca2+的速度增高。可见去甲肾上腺素有加强心肌兴奋-收缩偶联的作用,而心肌内去甲肾上腺素含量减少时,心肌的兴奋-收缩偶联过程就可能发生障碍。肥大而衰竭的心肌内去甲肾上腺素含量减少,除了可能与合成减少有关外,还可能是由于消耗过多。这是因为心输出量减少时,交感神经的活动加强,故交感神经末梢包括心肌交感神经末梢释放去甲肾上腺素增多。
此外,有些事实还说明心力衰竭时不仅有心肌儿茶酚胺含量的减少,而且心肌细胞肾上腺能受体的功能也发生了改变,例如在严重心力衰竭时,β受体受异丙基肾上腺素作用时细胞内不能产生正常量的cAM,提示可能此时β受体敏感性降低,因而cAMP产生不足。如前所述,cAMP的不足就可使Ca2+内流和肌质网摄取Ca2+不足,从而导致心肌兴奋-收缩偶联障碍。
在这方面,也有一些不同的见解。有人认为,虽然心力衰竭时心肌儿茶酚胺含量减少,但因心力衰竭患者交感神经活动加强,故血液中儿茶酚胺显著增多,而心肌对儿茶酚胺的敏感性也较高,故完全可能弥补心肌中儿茶酚胺的不足。
三、心肌的结构破坏
严重缺血时的心肌坏死,以及急性炎症时的心肌变性,坏死等可导致心肌收缩蛋白大量破坏,从而引起心肌收缩性显着减弱。
关于肥大心肌转向衰竭的机制,前文已经有几处提到。为了加深理解,下文将再就此问题作综合性的概述。
心肌肥大是一种强有力的代偿形式,然而它不是无限度的,如果病因历久而不能被消除,则肥大心肌的功能便不能长期维持正常而终转向心力衰竭。慢性心力衰竭一般都是在心肌代偿性肥大的基础上逐渐发生发展的。
肥大的心肌为何会转向衰竭?这是长期以来为人们进行探讨和研究的问题。目前认为,代偿性心肌肥大是一种不平衡的生长形式。这种在器官、组织、细胞、分子等不同的水平上都有其特征性表现的不平衡生长,是肥大心肌转向功能不全的基础。
(一)器官水平上的特征从整个心脏来看,不平衡生长表现为心脏重量的增长超过了支配心脏的交感神经元轴突的生长,因此心脏内交感神经分布的密集程度显著地低于正常。而且,肥大心肌中儿茶酚胺合成减少而消耗增多,因而心内去甲肾上腺素含量显著减少,这种神经支配和递质含量方面的变化,就会促使心肌兴奋-收缩偶联发生障碍,从而导致心肌收缩性减弱。
(二)组织水平上的特征表现在心肌内微动脉和毛细血管的生长明显地落后于心肌细胞体积的增长,所以单位重量的肥大心肌毛细血管数目减少。对哺乳类动物心肌微循环的活体组织研究表明,安静时,正常动物心肌每1mm3内约有2,300条开放的毛细血管,毛细血管平均间距为16.8μm。当心脏负荷加重或缺氧时,毛细血管前括约肌松弛,原处于贮备状态的约2,100条毛细血管也开放。这样,总的功能性毛细胞管可达4.400条/mm3,毛细血管间距因而减少到5.5μm。因而,由于负荷加重而增高的心肌需氧量,很快通过原运输加快而得到满足。然而在心肌肥大时,则因毛细血管总数相对减少,氧的弥散间距增大,故心肌缺氧。这样的患者在安静的状态下,大部分贮备毛细血管已经开放,故当负荷增加时,功能性毛细血管数不能再有显著的增加,氧的弥散间距也不能明显缩小。因此肥大心肌在负荷增加时常处于缺氧状态,致有氧代谢减弱,能量生成不足,心肌收缩性减弱。
关于肥大心肌是否缺氧的问题,也曾有过不同的见解,因为有人曾经测定过单位重量肥大心肌冠状动、静脉血液氧含量差,结果与正常心肌的情况无明显的差别,指示肥大心肌并不缺氧。
(三)细胞水平上的特征表现为细胞体积和重量的增加大于其表面积的增加,即肥大心肌的表面积与重量之比显著降低。而细胞表面的胞膜(sarcoplasmic membrane)正是Na+-K+、Na+-Ca2+等离子转运所必经的部位。故细胞面积的相对减少可使细胞转运离子的能力减弱,包括Ca2+内流相对不足,从而使心肌细胞的功能降低。近年来电子显微镜的观察还证实、肥大心肌内线粒体数量与心肌细胞体积的比值减小,线粒体膜表面积与心肌纤维重量的比值也明显减少,所以肥大心肌内生物氧化作用相对减弱。这也是肥大心肌能量生成不足的原因之一。
(四)分子水平上的特征 表现为肌球蛋白分子的重节片(头部)和轻节片(尾部)的比值降低,即头部在整个分子中所占的比重减少。而头部正是ATP酶所在的部位,头部比重的减少,就可使ATP酶的活性随之相对降低。此外,ATP酶又受Ca2+的激活,心力衰竭时,由于Ca2+向肌球蛋白横桥部位转运缓慢,故可使ATP酶活性进一步降低。体外实验表明,衰竭心肌中ATP酶的活性约降低20~30%。ATP酶活性的降低使心肌能量利用发生障碍,因而心肌收缩性减弱。
应当强调指出,临床上心力衰竭的发生发展,往往是多种机制共同作用的结果。例如,贫血和维生素B1缺乏主要引起心肌能量生成障碍,但当心肌因负荷加重而代偿性肥大,即发生心肌的不平衡生长时,又可发生心肌能量利用障碍和兴奋-收缩偶联障碍。高血压病慢性心瓣膜病引起心肌肥大时,固然以兴奋-收缩偶联障碍和能量利用障碍为主,然而在高度肥大的心肌中也可能存在着相对的缺血缺氧,因而也可有能量生成障碍。